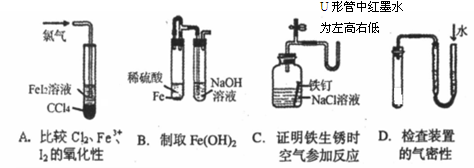
题目内容
信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
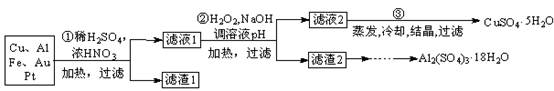
回答下列问题:
⑴第①步Cu与酸反应的离子方程式为 ;得到滤渣1的主要成分为 。
⑵第②步加入H2O2的作用是 ,使用H2O2的优点是 ;调节pH的目的是使 生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
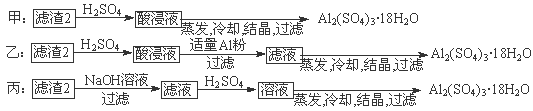
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子

回答下列问题:
⑴第①步Cu与酸反应的离子方程式为 ;得到滤渣1的主要成分为 。
⑵第②步加入H2O2的作用是 ,使用H2O2的优点是 ;调节pH的目的是使 生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:

上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
⑴Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;Au、Pt
3Cu2++2NO↑+4H2O;Au、Pt
⑵把Fe2+氧化为Fe3+;不引入杂质,产物对环境物无污染;Fe3+和Al3+。
⑶在坩埚中加热脱水
⑷甲;甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;乙。
⑸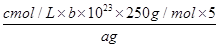 ×100%;c。
×100%;c。
 Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;Au、Pt
3Cu2++2NO↑+4H2O;Au、Pt⑵把Fe2+氧化为Fe3+;不引入杂质,产物对环境物无污染;Fe3+和Al3+。
⑶在坩埚中加热脱水
⑷甲;甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;乙。
⑸
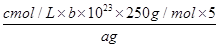 ×100%;c。
×100%;c。试题分析:(1)浓硝酸与稀硝酸混合,硝酸可能为浓溶液,也可能为稀溶液,所以两个离子方程式都可;Au、P他不和硝酸反应,所以滤渣1的主要成分为:Au、Pt。
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+;H2O2作氧化剂。其还原产物为H2O,所以该氧化剂的优点是不引入杂质,产物对环境物无污染;调溶液PH的目的是使Fe3+和Al3+形成沉淀。
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水。
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行。乙和丙方法均可行。乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。丙方案先在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3, 蒸发、冷却、结晶、过滤可得硫酸铝晶体。但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费。
(5)根据离子方程式,Cu2+的物质的量等于EDTA的物质的量,所以由EDTA的物质的量可求出CuSO4?5H2O的物质的量,因为配制了100mL CuSO4溶液,每次取20.00mL实验,所以再乘以5,可得样品中CuSO4?5H2O的物质的量,进而求出CuSO4?5H2O的含量;a、未干燥锥形瓶,为正确操作,不影响结构;b、滴定终点时滴定管尖嘴中产生气泡,使标准液的体积测量值变小,结构偏小;c、未除净可与EDTA反应的干扰离子,增加了EDTA的用量,使结果偏高。

练习册系列答案
相关题目
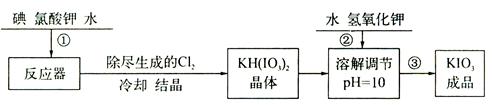
 2PCl3;2P+5Cl2(过量)
2PCl3;2P+5Cl2(过量)
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI