题目内容
18.如图是制备和收集气体的实验装置,该装置可用于( )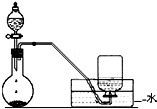
| A. | 浓硝酸与铜反应制取二氧化氮 | B. | 碳化钙与食盐水反应制取乙炔 | ||
| C. | 浓氨水和生石灰反应制取氨气 | D. | 浓盐酸和二氧化锰反应制取氯气 |
分析 由装置可知,反应在常温下进行,生成的气体可用排水法收集,说明气体不溶于水,以此解答该题.
解答 解:A.因二氧化氮溶于水且与水反应,则不能用排水法收集,故A错误;
B.碳化钙与食盐水在常温下反应制取乙炔,乙炔不溶于水,可用排水法收集,故B正确;
C.氨气极易溶于水,不能用排水法收集,故C错误;
D.浓盐酸和二氧化锰在加热条件下反应制备氯气,本题装置没有加热,故D错误.
故选B.
点评 本题考查了实验装置的选取,侧重于学生的分析、实验能力的考查,根据反应物状态和反应条件选取反应装置,根据气体的性质选取收集装置,难度不大.

练习册系列答案
相关题目
9.常温下,0.1mol•L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是( )
| A. | 0.01mol•L-1HA的溶液中c(H+)=1×10-4 mol•L-1 | |
| B. | PH=3的HA溶液与PH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-) | |
| D. | PH=3的HA溶液与PH=11的NaOH溶液按体积比1:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+) |
6.质量相等的硫酸和磷酸,它们的( )相等.
| A. | 物质的量 | B. | 原子个数 | C. | 氢原子个数 | D. | 分子中的电子数 |
13.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 中子数为1的氢原子:${\;}_{1}^{1}$H | ||
| C. | 甲基的电子式: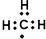 | D. | CO2的比例模型: |
3.下列离子方程式书写正确的是( )
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向Ba(NO3)2溶液中通入过量SO2:3Ba2++3SO2+2NO3-+2H2O═2NO↑+3BaSO4↓+4H+ | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |

 ,其合成路线如图所示:
,其合成路线如图所示: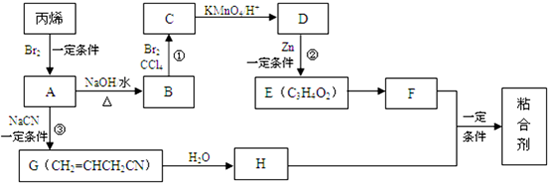
 .
. .
. .
.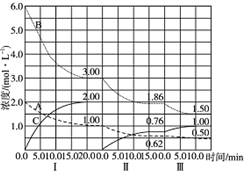 反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:
反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示: