题目内容
某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO4·5H2O。工艺流程如下
(部分操作和条件略):
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加H2O2溶液,稍加热。
III.向II的溶液中加入CuO粉末至pH=4。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1。
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体。
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
(1)II中发生反应的离子方程式是 。
(2)II中将Fe2+氧化为Fe3+的目的是 。
(3)用K3[Fe(CN)6](铁氰化钾)验证II中Fe2+是否转化完全的现象是 。
(4)III中发生反应的离子方程式是 。
通过计算说明在此条件下的溶液中Fe3+是否沉淀完全________________________(提示:当溶液中某离子浓度小于1.0×10–5 mol/L时可认为该离子沉淀完全)。
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因 。
(部分操作和条件略):
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加H2O2溶液,稍加热。
III.向II的溶液中加入CuO粉末至pH=4。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1。
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体。
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
| 物质 | Fe(OH)3 | Fe (OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀时pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10–38 | 8.0×10–16 | 2.2×10–20 |
(1)II中发生反应的离子方程式是 。
(2)II中将Fe2+氧化为Fe3+的目的是 。
(3)用K3[Fe(CN)6](铁氰化钾)验证II中Fe2+是否转化完全的现象是 。
(4)III中发生反应的离子方程式是 。
通过计算说明在此条件下的溶液中Fe3+是否沉淀完全________________________(提示:当溶液中某离子浓度小于1.0×10–5 mol/L时可认为该离子沉淀完全)。
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因 。
(1)2Fe2+ +H2O2+2H+=2Fe3++2H2O (2分) (2)在调节pH=4时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀。(表述合理即可得分) (2分)
(3)若有蓝色沉淀生成,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化。(只答出其中一种情况,表述正确得满分。) (1分)
(4)Fe3++3H2O Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O (或只书写第二个反应也可得分)
Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O (或只书写第二个反应也可得分)
或2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ (2分)
c(Fe3+)=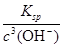 =4.0×10–8 mol·L–1<1.0×10–5 mol·L–1,故Fe3+沉淀完全 (2分)
=4.0×10–8 mol·L–1<1.0×10–5 mol·L–1,故Fe3+沉淀完全 (2分)
(5)用稀硫酸酸化至pH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体。(表述合理即可得分) (1分)
(3)若有蓝色沉淀生成,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化。(只答出其中一种情况,表述正确得满分。) (1分)
(4)Fe3++3H2O
 Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O (或只书写第二个反应也可得分)
Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O (或只书写第二个反应也可得分)或2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ (2分)
c(Fe3+)=
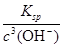 =4.0×10–8 mol·L–1<1.0×10–5 mol·L–1,故Fe3+沉淀完全 (2分)
=4.0×10–8 mol·L–1<1.0×10–5 mol·L–1,故Fe3+沉淀完全 (2分)(5)用稀硫酸酸化至pH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体。(表述合理即可得分) (1分)
试题分析:(1)由于溶液中含有亚铁离子,需要将其氧化为铁离子除去。双氧水具有氧化性,因此向滤液中滴加H2O2溶液,稍加热的目的是除去亚铁离子,反应的离子方程式为2Fe2+ +H2O2+2H+=2Fe3++2H2O。
(2)由于亚铁离子沉淀时的pH值大于铜离子沉淀时的pH值,而铁离子完全沉淀时的pH值是3.7,所以II中将Fe2+氧化为Fe3+的目的是在调节pH=4时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀。
(3)由于铁氰化钾与亚铁离子结合产生蓝色沉淀,据此可以检验亚铁离子。即若有蓝色沉淀生成,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化。
(4)氧化铜能消耗氢离子,降低溶液的酸性,从而产生氢氧化铁沉淀,因此反应的离子方程式为Fe3++3H2O
 Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O;氢氧化铁的溶度积常数是4.0×10–38,则当溶液中OH-等于10-10mol/L时,则此时溶液中c(Fe3+)=
Fe(OH)3+3H+ CuO+2H+=Cu2++ H2O;氢氧化铁的溶度积常数是4.0×10–38,则当溶液中OH-等于10-10mol/L时,则此时溶液中c(Fe3+)=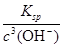 =4.0×10-8 mol·L-1<1×10-5 mol·L-1,故Fe3+沉淀完全。
=4.0×10-8 mol·L-1<1×10-5 mol·L-1,故Fe3+沉淀完全。(5)由于铜离子水解,溶液显酸性,所以用稀硫酸酸化至pH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体。

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
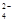 、OH―
、OH―