题目内容
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小____>______(填离子符号)。B所含的阴离子是________
(2)C溶液呈___性(填“酸性”或“碱性”),其原因是__________________
(用离子方程式解释)。D的化学式是____________
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为_______(设电解过程溶液体积不变),阳极的电极反应式为 _____
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为__________________________
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小____>______(填离子符号)。B所含的阴离子是________
(2)C溶液呈___性(填“酸性”或“碱性”),其原因是__________________
(用离子方程式解释)。D的化学式是____________
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为_______(设电解过程溶液体积不变),阳极的电极反应式为 _____
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为__________________________
(1)Na+> Al3+(1分) Cl-
(2)酸性 Al3++3H2O Al(OH)3+3H+ (NH4)2CO3
Al(OH)3+3H+ (NH4)2CO3
(3)13 2Cl- -2e-=Cl2(1分(4)C(Na+)> C(Cl-)>C(ClO-)>C(OH-)>C(H+)
(2)酸性 Al3++3H2O
 Al(OH)3+3H+ (NH4)2CO3
Al(OH)3+3H+ (NH4)2CO3(3)13 2Cl- -2e-=Cl2(1分(4)C(Na+)> C(Cl-)>C(ClO-)>C(OH-)>C(H+)
试题分析:
②根据A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,气体为氨气,①B溶液分别与C、D混合,均有白色沉淀生成;③A溶液与D溶液反应生成白色沉淀,再加过量A,沉淀量减少,至完全消失,④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体。则A为NaOH,C为Al2(SO4)2,B为Ba Cl2, D为(NH4)2CO3,
(1)Na+与 Al3+同一周期,核外电子排布相同,核电荷数越大,半径越小,所以Na+> Al3+;B为Ba Cl2,阴离子是氯离子。
(2)C为强酸弱碱盐,溶液呈酸性;其原因是Al3+水解所致,Al3++3H2O
 Al(OH)3+3H+
Al(OH)3+3H+D的化学式是(NH4)2CO3
(3)用惰性电极电解BaCl2,时,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,阴极上是氢离子得电子,2H++2e-═H2↑,当电源提供给0.1mol电子时,根据2H++2e-═H2↑可知,生成0.05mol氢气,所以溶液中氢氧根离子n(OH-)=0.1mol,此溶液体积为1L,溶液中c(OH-)="n" v ="0.1mol" /1L =0.1mol/L,c(H+)="Kw" /C(OH?) =10?14 /0.1 mol/L=10-13mol/L,所以pH=13,
(4)将④阳极产生的气体通入A溶液中至恰好完全反应时,即发生Cl2+2NaOH═NaCl+NaClO+H2O,得到的是等物质的量的NaCl、NaClO的混合溶液,NaClO是强碱弱酸盐,ClO-水解,溶液呈碱性,所以有:C(Na+)> C(Cl-)>C(ClO-)>C(OH-)>C(H+)

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
 HCO3-+H+
HCO3-+H+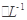 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度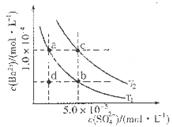
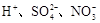 ,该溶液中还可能大量存在的离子组是
,该溶液中还可能大量存在的离子组是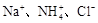
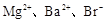
 、Cl-
、Cl-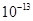 mol/L,一定会发生反应的离子组是
mol/L,一定会发生反应的离子组是