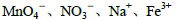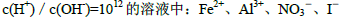题目内容
下列有关电解质溶液的叙述,不正确的是
| A.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 |
| B.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3 COO-) |
| C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,溶液中c(Ba2+)减小 |
| D.常温下,pH =2的盐酸与pH =12的氨水等体积混合所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
D
试题分析:A、稀醋酸加水稀释,醋酸电离程度增大,但H+浓度减小,溶液的pH升高,正确;B、CH3COONa溶液中CH3COO?水解浓度减小,加入适量CH3COOH可增加CH3COO?浓度,有可能使c(Na+)=c(CH3 COO-),正确;C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,促进BaSO4的沉淀溶解平衡向左移动,溶液中c(Ba2+)减小,正确;D、因为NH3?H2O为弱碱,所以pH =2的盐酸与pH =12的氨水等体积混合,NH3?H2O过量,离子浓度大小顺序为:c(NH4+)> c(Cl-) > c(OH-)> c(H+),错误。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目