题目内容
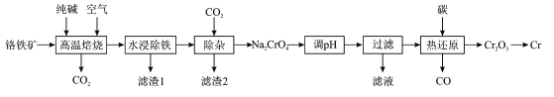
【题目】铬(Cr)硬度大抗腐蚀性和耐磨性好,具有广泛的应用前景一种以铬铁矿(含FeCr2O4及少量Al2O3SiO2等)为原料制备金属铬的工艺流程如下:
回答下列问题:
(1)“高温焙烧”中主要反应的化学方程式为____
(2)为提高“水浸”的浸取率,除了适当升高温度,还可采取的措施是____
(3)“滤渣1”是一种红棕色固体,为检验其中的金属元素,可选择的常用试剂是____“滤渣2”的主要成分是__________
(4)“调pH”的目的是____
(5)“热还原”主要是利用焦炭与重铬酸盐得到Cr2O3和另一种固体产物,该固体产物可返回__________工序循环使用
(6)可用铝热法还原Cr2O3制备铬单质,铝热反应中镁带的作用是____;还可用惰性电极电解硫酸铬钾[KCr(SO4)2]溶液制备,阴极的电极反应式为____
【答案】4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+CO2, 适当延长浸取时间或搅拌 盐酸(或稀硫酸)、KSCN溶液 H2SiO3和Al(OH)3 增大H+浓度,使平衡2
2Fe2O3+8Na2CrO4+CO2, 适当延长浸取时间或搅拌 盐酸(或稀硫酸)、KSCN溶液 H2SiO3和Al(OH)3 增大H+浓度,使平衡2![]() +2H+
+2H+![]() 2
2![]() +H2O方向移动,将Na2CO4转化为Na2Cr2O7 高温熔烧 引燃剂(或利用镁条燃烧放出的热量引发铝热反应) Cr3++3e-= Cr
+H2O方向移动,将Na2CO4转化为Na2Cr2O7 高温熔烧 引燃剂(或利用镁条燃烧放出的热量引发铝热反应) Cr3++3e-= Cr
【解析】
根据流程:铬铁矿[主要成分为Fe(CrO2)2,还含有Fe2O3、A12O3、SiO2等杂质]在空气中与纯碱高温煅烧,发生反应:Al2O3+Na2CO3![]() 2NaAlO2+CO2↑、SiO2+Na2CO3
2NaAlO2+CO2↑、SiO2+Na2CO3![]() Na2SiO3+CO2↑、4Fe(CrO2)2+7O2+8Na2CO3
Na2SiO3+CO2↑、4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+CO2,得到含有NaA1O2、Na2SiO3、Na2CrO4、Fe2O3的固体产物,水浸,Fe2O3不溶,滤渣I为Fe2O3,滤液I含有NaA1O2、Na2SiO3、Na2CrO4,通入二氧化碳调节pH值使NaA1O2、Na2SiO3转化为Al(OH)3和H2SiO3,发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,则滤渣2为Al(OH)3和H2SiO3,滤液主要含有CrO42-,再次调节pH发生反应:2CrO42-+2H+Cr2O72-+H2O,将CrO42-转化为Cr2O72-,用碳作还原剂,热还原法将Na2Cr2O7转化为Cr2O3同时生成碳酸钠和CO,发生反应:Na2Cr2O7+2C
2Fe2O3+8Na2CrO4+CO2,得到含有NaA1O2、Na2SiO3、Na2CrO4、Fe2O3的固体产物,水浸,Fe2O3不溶,滤渣I为Fe2O3,滤液I含有NaA1O2、Na2SiO3、Na2CrO4,通入二氧化碳调节pH值使NaA1O2、Na2SiO3转化为Al(OH)3和H2SiO3,发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,则滤渣2为Al(OH)3和H2SiO3,滤液主要含有CrO42-,再次调节pH发生反应:2CrO42-+2H+Cr2O72-+H2O,将CrO42-转化为Cr2O72-,用碳作还原剂,热还原法将Na2Cr2O7转化为Cr2O3同时生成碳酸钠和CO,发生反应:Na2Cr2O7+2C![]() Na2CO3+ Cr2O3+CO↑;利用铝热法还原Cr2O3制取金属铬,据此分析解答。
Na2CO3+ Cr2O3+CO↑;利用铝热法还原Cr2O3制取金属铬,据此分析解答。
(1)“高温焙烧”中主要反应的化学方程式为4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+CO2;
2Fe2O3+8Na2CrO4+CO2;
(2)为提高“水浸”的浸取率,除了适当升高温度,还可采取的措施是适当延长浸取时间或搅拌;
(3)根据分析,滤渣I为Fe2O3,为检验其中的金属元素,先用盐酸(或稀硫酸)溶解转化为Fe3+,再加入KSCN溶液,若溶液变为血红色,则证明含有铁元素;“滤渣2”的主要成分是Al(OH)3和H2SiO3;
(4)调节pH的目的是增大溶液中H+的浓度,使反应2CrO42-+2H+Cr2O72-+H2O平衡正向移动,使Na2CrO4转化为Na2Cr2O7;
(5)“热还原”主要是利用焦炭与重铬酸盐得到Cr2O3和另一种固体产物,发生反应:Na2Cr2O7+2C![]() Na2CO3+ Cr2O3+CO↑,该Na2CO3固体产物可返回高温熔烧工序循环使用;
Na2CO3+ Cr2O3+CO↑,该Na2CO3固体产物可返回高温熔烧工序循环使用;
(6)可用铝热法还原Cr2O3制备铬单质,铝热反应中镁带的作用是作引燃剂,利用镁条燃烧放出的热量引发铝热反应;还可用惰性电极电解硫酸铬钾[KCr(SO4)2]溶液制备,阴极上电解质溶液中的阳离子放电,根据放电顺序,Cr3+在阴极放电,电极反应式为Cr3++3e-= Cr。

【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图I碱性锌锰电池 | 图II铅-硫酸蓄电池 | 图III电解精炼铜 | 图IV银锌纽扣电池 |
A.图Ⅰ所示电池中,正极的电极反应式为Zn-2e+2OH-=Zn(OH)2
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池工作过程中,电子由Zn极沿导线流向Ag2O极