题目内容
【题目】甲醇是一种可再生的绿色能源,![]() 是一种温室气体,都是重要的化工原料。
是一种温室气体,都是重要的化工原料。
(1)已知CO(g)+2H2(g)![]() CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。

①Q_______(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是_________。
②t1时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__________;
④欲提高H2的转化率,可采取的措施有______________________,(写出两种);
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①请写出CO2的电子式_______________________________。
②NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(NaHCO3)∶c(Na2CO3)=1∶1,则所得溶液的离子浓度的大小关系是____________。
③在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是____________________________________。
【答案】< < a、b 小于 4 降低温度、增大二氧化碳的量、增大压强 ![]() c(Na+)> c(HCO
c(Na+)> c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ)>c(H+) CaSO4难溶于酸,而CaCO3易溶于酸中
)> c(OHˉ)>c(H+) CaSO4难溶于酸,而CaCO3易溶于酸中
【解析】
(2)图示各点表示t1时刻各容器中H2O的体积分数(H2O),据图可知c点之前随温度上升H2O的体积分数增大,c点之后随温度的上升减小,说明在c点之前a、b两点在t1时刻时反应还未达到平衡,c点之后的d、e二点反应达到平衡;且随温度升高,平衡时水的体积分数减小,说明升高温度,平衡逆向移动,正反应为放热反应。
(1)该反应是气体减少的反应,所以ΔS<0;
(2)①根据分析可知该反应正反应为放热反应,焓变小于零,所Q<0;五个容器中肯定处于非平衡状态的是a、b;
②容器a中温度小于容器e中的温度,两容器中水的体积分数相差不大,所以速率主要受温度影响,则容器a中正反应速率小于容器e中正反应速率;
③初始投料为3molCO2、7molH2,设平衡时转化的CO2为x,容器体积为1L,列三段式有:
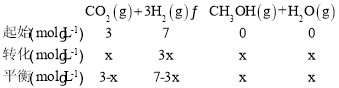
该温度下平衡时H2O的体积分数为![]() ,则有
,则有![]() ,解得x=2,所以平衡时CO2、H2、CH3OH、H2O的浓度分别为1mol/L、1mol/L、2mol/L、2mol/L,平衡常数K=
,解得x=2,所以平衡时CO2、H2、CH3OH、H2O的浓度分别为1mol/L、1mol/L、2mol/L、2mol/L,平衡常数K=![]() =4;
=4;
④该反应为体积减小的放热反应,所以欲提高H2的转化率,可以降低温度或者增大二氧化碳的量或者增大压强;
(3)①CO2为共价化合物,其电子式为![]() ;
;
②溶液中c(NaHCO3)∶c(Na2CO3)=1∶1,钠离子不发生水解,所以c(Na+)最大,碳酸根的水解程度大于碳酸氢根,所以c(HCO![]() )>c(CO
)>c(CO![]() ),碳酸根和碳酸氢根的水解使溶液显碱性,所以c(OHˉ)>c(H+),水解是微弱的,则溶液中c(Na+)> c(HCO
),碳酸根和碳酸氢根的水解使溶液显碱性,所以c(OHˉ)>c(H+),水解是微弱的,则溶液中c(Na+)> c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ)>c(H+)
)> c(OHˉ)>c(H+)
③因为CaSO4难溶于酸,难除去,而CaCO3易溶于酸中从而易除去,所以在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案