��Ŀ����
����Ŀ���Ҵ��ķе���78�棬����ˮ������Ȼ��ܣ������Ȼ��ƽ�������������ѵķе�Ϊ34��.6�棬������ˮ�����Ѽ���ȼ�գ�ʵ���������ѵķ�Ӧԭ����2CH3CH2OH ![]() CH3CH2��O��CH2CH3�����ѣ�+H2O
CH3CH2��O��CH2CH3�����ѣ�+H2O
ʵ�鲽�裺
�����ѵ��Ʊ�
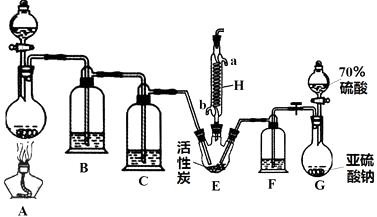
�ڷ�Һ©���м���2mL 95%���Ҵ�����һ�����������ƿ�з���12mL 95%���Ҵ�������ˮԡ�е���ȴ�±�ҡ����������12mLŨ���ᣬʹ��Ͼ��ȣ�������2����ʯ��ʵ��װ����ͼ������Ӧƿ���ڵ������ϼ��ȣ�ʹ�¶�Ѹ�ٵ�������140�棬��ʼ�ɷ�Һ©�������μ��Ҵ����������ٲ������¶���135��140��֮�䣮���Ҵ����������Ӧ10min��ֱ���¶�������160��ֹ���ر���Դ��ֹͣ��Ӧ��
�����ѵľ���
������ﵹ���Һ©���У�������8mL 15% NaOH��Һ��8mL����ʳ��ˮϴ�ӣ��������8mL�����Ȼ�����Һϴ��2�Σ���־��ú��Һ�������ѵ���������ƿ�У��ÿ�״��ˮ�Ȼ��Ƹ�������Ѹ�����뵽����װ��������ˮԡ�����ռ�33��38�����֣�
�����������Ϣ������������⣺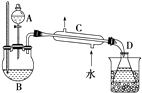
��1�����ѵ��Ʊ��;��ƹ����ж���Ҫʹ�÷�ʯ���������� �� ���ʵ�������Ǽӷ�ʯ����Ҫ��ô������ ��
��2�����ѵ��Ʊ��;��ƹ����ж���Ҫʹ���¶ȼƣ���ˮ����λ���Ƿ���ͬ������ǡ�����ԭ����
��3������C������Ϊ ��
��4������¶�̫�ߣ����ᷢ������Ӧ�������� ��
��5�����������У�����15% NaOH��Һ�������� �� ���뱥���Ȼ�����Һ�������� ��
���𰸡�
��1����ֹ���У�ֹͣ���ȣ���ȴ�ӷ�ʯ
��2�����Ʊ�Ҫ���Ʒ�ӦҺ���¶ȣ�ˮ����Ҫ���ڷ�ӦҺ�����Ҫ����ݵ��¶ȣ�Ҫ����֧�ܿڴ�
��3����ֱ�Σ�������
��4����ϩ
��5����ȥ�������ʣ����Ҵ�
���������⣺��1��Һ����ȼӷ�ʯ���Ƿ�ֹҺ���ٷУ����ʵ�������Ǽӷ�ʯ��ֹͣ���ȣ���ȴ�ӣ�����Ҳ�������ٷУ��������ѵ��Ʊ��;��ƹ����ж���Ҫʹ�÷�ʯ���������Ƿ�ֹ���У����ʵ�������Ǽӷ�ʯ��ֹͣ���ȣ���ȴ�ӣ����Դ��ǣ���ֹ���У�ֹͣ���ȣ���ȴ�ӣ�
��2.�����ѵ��Ʊ�������Ҫ������Ӧ��Һ���¶ȣ�����ˮ����λ������Һ�м䣬�����ƹ�������Ҫ����������ķе㣬ˮ����λ����������ƿ��֧�ܴ����������ǵ�λ�ò�ͬ�����Դ��ǣ����Ʊ�Ҫ���Ʒ�ӦҺ���¶ȣ�ˮ����Ҫ���ڷ�ӦҺ�����Ҫ����ݵ��¶ȣ�Ҫ����֧�ܿڴ���
��3.������װ��ͼ��֪����C������Ϊ�����ܣ����Դ��ǣ���ֱ�Σ������ܣ�
��4.���Ҵ���Ũ���������¼��ȵ�170��Ϳ���������ϩ������¶�̫�ߣ����ᷢ������Ӧ����������ϩ�����Դ��ǣ���ϩ��
��5.�����������У�������п������������ʣ���������Ҵ��������ñ����Ȼ�����Һ��ȥ�����������У�����15% NaOH��Һ�������� ��ȥ�������ʣ����뱥���Ȼ�����Һ�������dz��Ҵ���
���Դ��ǣ���ȥ�������ʣ����Ҵ���

����Ŀ��������ֲ��֦Ҷ��ȡ�ľ����к������мס��ҡ������ֳɷ֣�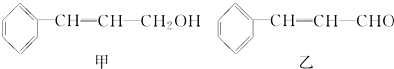
�������±���
����ʽ | C16H14O2 |
�������� | ��ʹBr2/CCl4��ɫ |
����ϡH2SO4��ˮ�� |
��1���ķ���ʽΪ��
��2���ɼ�ת��Ϊ���辭���й��̣�����ȥ������Ӧ���ز����ͬ����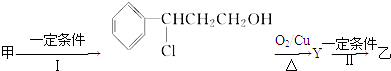
��Ӧ��Ļ�ѧ����ʽΪ��ע����Ӧ��������
��3����֪��RCH�T CHR�� ![]() RCHO+R��CHO��2CHO
RCHO+R��CHO��2CHO ![]() HCOOH+CH3OH
HCOOH+CH3OH
�����Ʊ���һ�ֺϳ�·��ͼ���£�A��F��Ϊ�л��ͼ��Mr��ʾ��Է�����������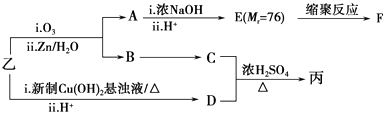
���������ʲ�����C��Ӧ������ѡ����ţ���
a�������ơ�b������ c��Na2CO3��Һ��d�� HBr
��д��F�Ľṹ��ʽ ��
��D�ж���ͬ���칹�壬��д����һ����ͬʱ���������������칹��Ľṹ��ʽ ��
a���������������ֲ�ͬ������ b���ܷ���������Ӧ
c������Br2/CCl4�����ӳɷ�Ӧ d����FeCl3��Һ��ʾ������ɫ
�����Ϸ��������Ľṹ��ʽΪ ��