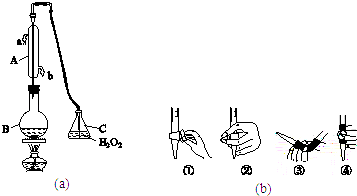��Ŀ����
����Ŀ��ij������ˮ�к�����̬����ͨ������ʵ��ⶨ��Ũ��
��ȡˮ��10.0mL����ƿ������10.0mLKI��Һ��������������ָʾ��2��3�Σ�
��ȡһ�ζ�������������ˮ������ˮϴ����Ȼ��ע��0.01molL��1��Na2S2O3��Һ������Һ�棬���¶�����
�۽���ƿ���ڵζ����½��еζ��������ķ�ӦΪ��I2+2Na2S2O3=2NaI+Na2S4O6 ��
�Իش��������⣺
��1������ټ����ָʾ���� ��
��2�������Ӧʹ��ʽ�ζ��ܣ�
��3���������ζ��յ������ ��
��4������ȥNa2S2O3��Һ20.00mL�����ˮ��C12�����ʵ���Ũ��Ϊ ��
��5����ָ��ʵ���е�һ�����Դ��� ��
���𰸡�
��1��������Һ
��2����
��3�������һ����Һ������ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ
��4��0.01mol/L
��5������ڵζ���������ˮϴ����δ�ô���Һ��ϴ
���������⣺��1����Һ���е��ʵ⣬���������Һ����ɫ�������������Ʒ���������ԭ��Ӧ������Ӧ�յ�ʱ����ɫ��ȥ�����Դ��ǣ�������Һ����2�������������Һ�Լ��ԣ�Ӧѡ���ʽ�ζ��ܣ�
���Դ��ǣ����3���������۱���ɫ��������Һ����ɫ���淴ӦI2+2Na2S2O3=2NaI+2Na2S4O6���У���Һ��û�е⣬��Һ����ɫΪ��ɫ��˵����Ӧ���յ㣬�жϴﵽ�ζ��յ��ʵ�������ǣ������һ����Һ������ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��
���Դ��ǣ������һ����Һ������ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��
4�����ݷ�ӦCl2+2I��=2Cl��+I2 �� I2+2Na2S2O3=2NaI+Na2S4O6��
����Cl2��2Na2S2O3
1 2
n 0.01molL��1��0.0200L
n=0.0001ml
c��Cl2��= ![]() =0.01mol/L��
=0.01mol/L��
���Դ��ǣ�0.01mol/L����5����ʽ�ζ���δ��Na2S2O3��Һ��ϴ��ʹ��Na2S2O3��ҺŨ��ƫС�����ĵ�Na2S2O3��Һ���ƫ���I2�����ʵ���ƫ�࣬����ʵ���е�һ�����Դ���Ϊ����ڵζ���������ˮϴ����δ�ô���Һ��ϴ�����Դ��ǣ�����ڵζ���������ˮϴ����δ�ô���Һ��ϴ��

 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�