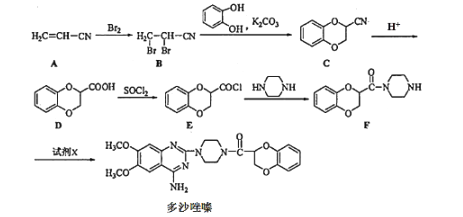
��Ŀ����
����Ŀ��NaClO2��Ư��������Ư�۵�45����NaClO2�㷺������ֽ��ҵ����ˮ�����ȡ���ҵ������NaClO2�Ĺ�������������
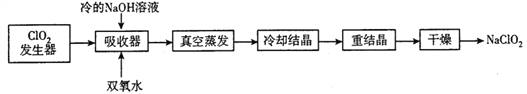
��1��ClO2�������еķ�ӦΪ2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4��ʵ�ʹ�ҵ�����п�����ơ�Ũ������淴Ӧԭ���е�SO2,��ԭ����_________________(�û�ѧ����ʽ��ʾ)��
��2����Ӧ������,��ClO2��������ͨ��һ����������Ŀ����_________________��
��3��������������NaClO2��Ӧ�����ӷ���ʽΪ_________________,�������еķ�Ӧ�¶Ȳ��ܹ���,���ܵ�ԭ��Ϊ_________________��
��4��ij��ѧ��ȤС��������ͼ��ʾװ���Ʊ�SO2��̽��SO2��Na2O2�ķ�Ӧ��
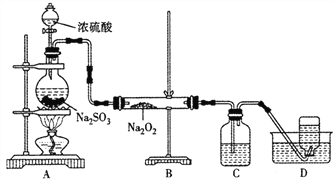
��Ϊ��ȥ������SO2,C��ʢ�ŵ��Լ�Ϊ___________��
��D���ռ����������ʹ�������ľ����ȼ,B��Ӳ�ʲ������ڿ϶�������Ӧ�Ļ�ѧ����ʽΪ_________________��
����ͬѧ��ΪB��Ӳ�ʲ������ڿ��ܻ���Na2SO4���ɡ�Ϊ�����Ƿ���Na2SO4���ɣ�������������·�����
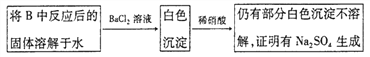
ͬѧ�Ǿ�������,��Ϊ��������������,����������a��____________��b��____________��
���𰸡� S+2H2SO4(Ũ)![]() 3SO2��+2H2O ���ϳ�ClO2��ȷ���䱻������� ��ֹH2O2�ֽ� 2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O NaOH��Һ(��KMnO4��Һ) 2Na2O2+2SO2=2Na2SO3+O2 ϡ�����ܽ������ᱵ����Ϊ���ᱵ �����Ӧ��Ĺ����л�����Na2O2,������ˮ���ܽ�������������������
3SO2��+2H2O ���ϳ�ClO2��ȷ���䱻������� ��ֹH2O2�ֽ� 2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O NaOH��Һ(��KMnO4��Һ) 2Na2O2+2SO2=2Na2SO3+O2 ϡ�����ܽ������ᱵ����Ϊ���ᱵ �����Ӧ��Ĺ����л�����Na2O2,������ˮ���ܽ�������������������
����������1��ClO2�������еķ�ӦΪ�����������������Ũ���������·���������ԭ��Ӧ������ǡ�Ũ����Ҳ�������ɶ�������Ӧ�ķ���ʽΪS+2H2SO4(Ũ)![]() 3SO2��+2H2O����2����Ӧ��������������������ClO2���ÿ������Խ����ų���ȷ���䱻������գ���3����������˫��ˮ��ClO2�ڼ��������·���������ԭ��Ӧ����NaClO2����Ӧ�����ӷ���ʽΪ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O��Ϊ�����ClO2�������ʼ���ֹH2O2�ֽ⣬��Ӧ�¶Ȳ��ܹ��ߣ���4���ٶ��������ܱ�����������Һ����������Һ���գ�����C��ʢ�ŵ��Լ�ΪNaOH��Һ����KMnO4��Һ������D���ռ����������ʹ�������ľ����ȼ��˵������������������B�з����ķ�Ӧ����Ϊ����������������Ʒ�Ӧ�����������ƺ���������Ӧ�ķ���ʽΪ2Na2O2+2SO2=2Na2SO3+O2��������ϡ�������ǿ�����ԣ��ܽ������ᱵ����Ϊ���ᱵ�����������Ӧ��Ĺ����л�����Na2O2,������ˮ��Ҳ�ܽ������������������������Է�����������
3SO2��+2H2O����2����Ӧ��������������������ClO2���ÿ������Խ����ų���ȷ���䱻������գ���3����������˫��ˮ��ClO2�ڼ��������·���������ԭ��Ӧ����NaClO2����Ӧ�����ӷ���ʽΪ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O��Ϊ�����ClO2�������ʼ���ֹH2O2�ֽ⣬��Ӧ�¶Ȳ��ܹ��ߣ���4���ٶ��������ܱ�����������Һ����������Һ���գ�����C��ʢ�ŵ��Լ�ΪNaOH��Һ����KMnO4��Һ������D���ռ����������ʹ�������ľ����ȼ��˵������������������B�з����ķ�Ӧ����Ϊ����������������Ʒ�Ӧ�����������ƺ���������Ӧ�ķ���ʽΪ2Na2O2+2SO2=2Na2SO3+O2��������ϡ�������ǿ�����ԣ��ܽ������ᱵ����Ϊ���ᱵ�����������Ӧ��Ĺ����л�����Na2O2,������ˮ��Ҳ�ܽ������������������������Է�����������

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�