��Ŀ����
����Ŀ��ij������ȫ���ҵIJ���ҩ����Ҫ����NaN3��Fe2O3��KClO4��NaHCO3�����ʡ�������������ײʱ������ҩ��������������ʹ����Ѹ�����ͣ��Ӷ��������á�
��1��NaN3�����巢���������ȷֽ����N2��Na��N2�ĵ���ʽΪ____��
��2��Fe2O3��������������Na��Ӧ���ɵĻ�ԭ����Ϊ____����֪�÷�ӦΪ�û���Ӧ����
��3��KClO4��������������Ӧ��������Na��������KCl��Na2O��KClO4���л�ѧ��������Ϊ__________��K��ԭ�ӽṹʾ��ͼΪ________��
��4��NaHCO3����ȴ�������ղ����������ͷŵ������������ֽ⣬�仯ѧ����ʽΪ__________________��
��5��100 g��������ҩ������������ͨ����ʯ�Һ�õ�N2 33.6 L����״������
���ü�ʯ�ҳ�ȥ������Ϊ____��
�ڸò���ҩ����NaN3����������Ϊ____��
���𰸡� ��NN�� Fe ���Ӽ����ۼ� 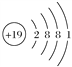 2NaHCO3
2NaHCO3![]() Na2CO3��CO2����H2O CO2��H2O 65%
Na2CO3��CO2����H2O CO2��H2O 65%
����������1��N2�ǷǼ��Է��ӣ������ڵ��뵪֮������������Ӷԣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]()
��2��Fe2O3��������������Na�����û���Ӧ��FeԪ�ط�����ԭ��Ӧ����ԭ����ΪFe���ʴ�Ϊ��Fe��
��3��KClO4�ɼ����������������ӹ��ɣ��������������Clԭ����Oԭ��֮���γɹ��ۼ����������Ӽ������ۼ���Kԭ��������Ϊ19��ԭ�Ӻ�����4�����Ӳ㣬���������Ϊ2��8��8��1��ԭ�ӽṹʾ��ͼΪ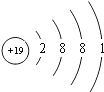 ���ʴ�Ϊ�����Ӽ������ۼ���
���ʴ�Ϊ�����Ӽ������ۼ��� ��
��
��4��̼�����Ʒֽ�����̼���ơ�������̼��ˮ����Ӧ����ʽΪ��2NaHCO3![]() Na2CO3+CO2��+H2O���ʴ�Ϊ��2NaHCO3
Na2CO3+CO2��+H2O���ʴ�Ϊ��2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
��5���ټ�ʯ�ҿ������ն�����̼��ˮ�������ü�ʯ�ҳ�ȥ������ΪCO2��H2O���ʴ�Ϊ��CO2��H2O��
�ڵ��������ʵ���![]() =1.5mol�����ݵ�Ԫ���غ�n��NaN3��=
=1.5mol�����ݵ�Ԫ���غ�n��NaN3��=![]() =1mol����m��NaN3��=1mol��65g/mol=65g����NaN3����������Ϊ
=1mol����m��NaN3��=1mol��65g/mol=65g����NaN3����������Ϊ![]() ��100%=65%���ʴ�Ϊ��65%��
��100%=65%���ʴ�Ϊ��65%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�