题目内容
17.下列溶液中NO3-的物质的量浓度最大的是( )| A. | 500 mL 1 mol/L的HNO3溶液 | B. | 1 L 0.5 mol/L的Fe(NO3)3溶液 | ||
| C. | 100 mL 0.5 mol/L的Mg(NO3)2溶液 | D. | 300 mL 1 mol/L的Mg(NO3)2溶液 |
分析 硝酸根离子的物质的量浓度与溶质的浓度及其化学式组成有关,与溶液的体积大小无关,据此对各选项进行计算和判断.
解答 解:A.500mL 1mol/L的HNO3溶液中含有硝酸根离子的浓度为1mol/L;
B.1L 0.5mol/L的Fe(NO3)3溶液中NO3-的物质的量浓度为:0.5mol/L×3=1.5mol/L;
C.100 mL 0.5 mol/L的Mg(NO3)2溶液中NO3-的物质的量浓度为:0.5mol/L×2=1mol/L;
D.300mL 1 mol/L的Mg(NO3)2溶液中NO3-的物质的量浓度为:1mol/L×2=2mol/L;
根据分析可知,溶液中NO3-的物质的量浓度最大的是D,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意粒子的物质的量浓度与溶液的体积大小无关,为易错点.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
5.下列说法中正确的是( )
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 丙烯能发生加成反应,还能使酸性KMnO4溶液褪色 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
12.可用分液漏斗分离的一组混合物是( )
| A. | 苯和酒精 | B. | 四氯化碳和溴 | C. | 苯和水 | D. | 醋酸和水 |
7.在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
(1)为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(2)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
滴定过程中发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.滴定终点的现象是滴入最后一滴高锰酸钾溶液,锥形瓶内溶液由浅绿色变为浅紫色,且30s不变色.通过实验数据计算的该产品纯度为$\frac{980c}{a}$×100%(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是BC(填符号).
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
(1)为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(2)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
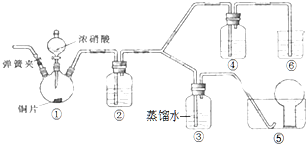 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.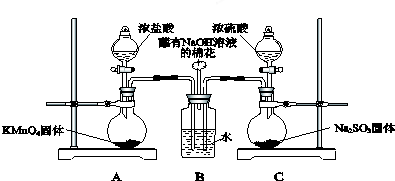

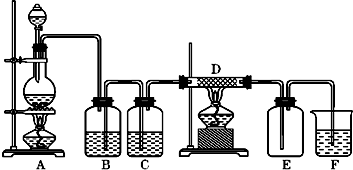
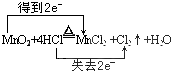 .
.