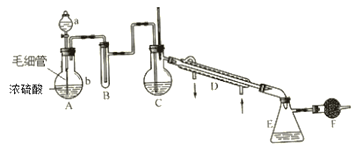
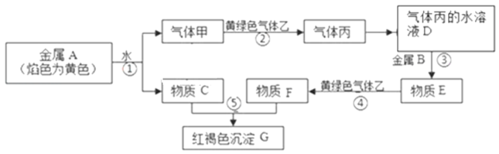
题目内容
【题目】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2在该反应中( )
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mol电子
D.相同条件下,每吸收10L SO2就会放出2.5LCO2
【答案】AD
【解析】
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,据此分析。
A.由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,故A正确;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移![]() mol电子,故C错误;
mol电子,故C错误;
D.根据方程式可知,每当4molSO2参与氧化还原反应就会放出1molCO2,则每10LSO2参与反应就会放出2.5LCO2,故D正确;
故答案为AD。

 阅读快车系列答案
阅读快车系列答案【题目】中国科学家用金属钠和![]() 在一定条件下制得了金刚石:
在一定条件下制得了金刚石:![]() (金刚石)
(金刚石)
钠 |
| 金刚石 | 石墨 | |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生 | —— | 4250 |
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式____,若![]() ,则________(选填序号)。
,则________(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(2)若反应在10L密闭容器、常压下进行,5min内,测得金刚石的质量增加了6g,该时间段内![]() ________,若反应温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将________(选填“增大”、“减小”或“不变”)。
________,若反应温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将________(选填“增大”、“减小”或“不变”)。
(3)反应中还有石墨生成,已知:![]() ,若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是________反应(填“吸热”或“放热”)。
,若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是________反应(填“吸热”或“放热”)。