题目内容
10.(1)将5.3gNa2CO3溶于水配成1L溶液,要使Na+浓度变为0.2mol/L,需要加入NaCl固体5.85g.(2)已知某NaOH溶液中,钠离子和水分子个数比为1:100,则该NaOH溶液的质量分数为2.2% (计算结果保留2位有效数字).
(3)已知硫酸溶液的浓度越大密度也越大,98%的浓H2SO4的物质的量浓度为18.4mol/L.据此判断49%的H2SO4溶液的物质的量浓度小于(填“大于”“小于”或“等于”)9.2mol/L.
(4)某固体单质,其密度为5g/cm3.用X射线研究该固体的结果表明:在棱长为1×10-7 cm的立方体中含有20个原子,则此元素的相对原子质量最接近150.
分析 (1)根据n=$\frac{m}{M}$计算碳酸钠物质的量,根据n=cV计算溶液中钠离子物质的量,根据钠离子守恒计算NaCl物质的量,再根据m=nM计算NaCl的质量;
(2)钠离子和水分子个数比为1:100,则NaOH与水的物质的量之比为1:100,根据n=nM计算出二者的质量之比,再计算出氢氧化钠溶液的质量分数;
(3)根据c=$\frac{1000ρω}{M}$及硫酸溶液的浓度越大时,其溶液的密度越大来分析
(4)根据m=ρV可计算质量,1mol原子的质量在数值上等于其相对原子质量.
解答 解:(1)5.3g碳酸钠的物质的量为:$\frac{5.3g}{106g/mol}$=0.05mol,0.05mol碳酸钠中含有0.1mol钠离子,
1L钠离子浓度为 0.2mol/L的溶液中含有钠离子的物质的量为:0.2mol/L×1L=0.2mol,
需要加入氯化钠的物质的量为:0.2mol-0.1mol=0.1mol,0.1molNaCl的质量为:58.5g/mol×0.1mol=5.85g,
故答案为:5.85;
(2)钠离子和水分子个数比为1:100,则该溶液中氢氧化钠与水的物质的量之比为1:100,溶液中NaOH与水的质量之比为:1×40:100×18=1:45,则该溶液中氢氧化钠的质量分数为:$\frac{1}{1+45}$×100%≈2.2%,
故答案为:2.2%(或0.022);
(3)设49%的硫酸溶液的浓度为为c,98%的浓硫酸的密度为ρ1,49%的硫酸溶液的密度为ρ2,
则18.4mol/L=$\frac{1000{ρ}_{1}98%}{98}$、c=$\frac{1000{ρ}_{2}×49%}{98}$,
由硫酸溶液的浓度越大时,其溶液的密度越大,
则ρ1>ρ2,所以c<9.2mol.L-1,
故答案为:小于;
(4)20个原子的质量为 5×(1×10-7)3g=5×10-21g,所以一个原子的质量为:2.5×10-22g,则NA个质量为:6.02×1023×2.5×10-22=150.5g,故摩尔质量为 150.5g/mol,则此元素的原子相对质量约为150,
故答案为:150.
点评 本题考查了物质的量的计算,题目难度中等,涉及质量、溶质质量分数、相对分子质量的计算,明确物质的量与摩尔质量、物质的量浓度等之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 一种分散系中可以有一种分散质,也可以有多种分散质 | |
| B. | 胶体的分散质都能通过过滤从分散剂中分离出来 | |
| C. | 分散剂一定是液体 | |
| D. | 同一种溶质的饱和溶液要比不饱和溶液的浓度大 |
| A. | 常温常压下22.4LCO2分子数少于NA | B. | 1molNaHCO3固体中含有NA个CO32- | ||
| C. | NA个NO与NA个O2混合分子数为2NA | D. | 1molCu反应转移电子数一定是2NA |
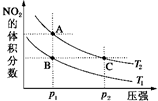 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |