题目内容
【题目】某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水。为防止污染环境,现采用下列工艺流程进行处理后再排出。
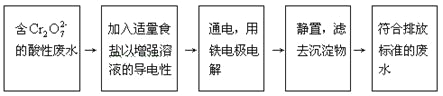
在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(1)电解时,铁电极上的电极反应式:
阳极:__________________________________,
阴极:__________________________________。
(2)用铁(而不用炭)作电极进行电解的原因:__________________________。
(3)Cr2O72-在酸性环境中被还原剂还原,能除去Cr2O72-。减少溶液酸性是整个工艺流程中关键的一步,这个变化的离子方程式是____________。
(4)溶液的pH值逐渐增大的原因是______________________。
【答案】Fe-2e-=Fe2+ 2H++2e-=H2↑ 产生还原剂Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O Cr2O72-还原时消耗H+,电解时阴极H+放电,都使溶液酸性减弱,pH值升高
【解析】
实验原理是:
电解产生Fe2+,将Cr2O72-被还原为Cr3+;
电解消耗溶液中的H+,降低了溶液的酸性,从而生成Cr(OH)3沉淀。
(1)电解时,阳极电解活性电极铁,电极反应式为:Fe-2e-=Fe2+,阴极电解溶液中的阳离子氢离子,电极反应式为:2H++2e-=H2↑;
(2)炭是惰性电极,铁是活性电极,用铁作电极进行电解能产生还原剂Fe2+,在酸性溶液中与Cr2O72-离子发生氧化还原反应,将Cr2O72-被还原为Cr3+;
(3)Cr2O72-在酸性环境中被还原剂Fe2+还原,能减少溶液酸性,该离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)在电解过程中,阴极消耗了溶液中的H+产生氢气,降低了溶液的酸性,同时,在Cr2O72-与Fe2+反应被还原为Cr3+的过程中,又消耗了溶液中的H+使溶液的酸性减弱,从而生成Cr(OH)3沉淀,降低了废水中有害物质铬的污染。所以,导致溶液pH值升高的原因有上述两个。

 阅读快车系列答案
阅读快车系列答案