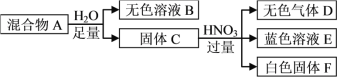题目内容
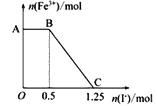
【题目】向NaOH和Na2CO3的混合溶液中滴加0.2mol·L-1稀盐酸,生成CO2的物质的量与加入盐酸的体积(V L)的关系如图所示。下列说法正确的是
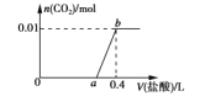
A.在0~a范围内,只发生中和反应
B.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为6:1
【答案】C
【解析】
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸发生的反应依次为H++OH-=H2O、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,据此可以解答。
A. 在0-a范围内,发生的反应应该是H++OH-=H2O、CO32-+H+=HCO3-,不止有中和反应,故A错误;
B. ab段发生反应的离子方程式为HCO3-+H+=H2O+CO2↑,故B错误;
C. 生成CO2的物质的量是0.1mol,则根据方程式HCO3-+H+=H2O+CO2↑可知,消耗盐酸的物质的量是0.1mol,所以a=0.3,故C正确;
D. 根据方程式和图像可知碳酸钠的物质的量是0.1mol,共计消耗盐酸是0.2mol,所以与氢氧化钠反应的盐酸是0.4mol-0.2mol=0.2mol,则氢氧化钠的物质的量是0.2mol,因此原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,故D错误;
正确答案是C。

练习册系列答案
相关题目