题目内容
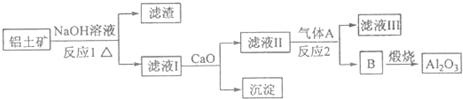
14.铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.①铝土矿的主要成分是Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如图:
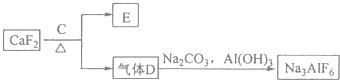
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图:
回答下列问题:
(1)写出反应1的化学方程式2NaOH+SiO2=Na2SiO3+H2O;2NaOH+Al2O3=2NaAlO2+H2O;
(2)若气体A过量,则反应2的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)写出由D制备冰晶石的化学方程式12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
(4)以石墨为阳极,电解氧化铝制铝时阳极的电极反应式2O2--4e-=O2↑.
分析 由工艺流程可知:铝土矿投入氢氧化钠,二氧化硅与 氢氧化钠反应生成硅酸钠和水,氧化铝与氢氧化钠反应生成偏铝酸钠和水,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀,滤液通入二氧化碳反应生成氢氧化铝沉淀,氢氧化铝分解生成氧化铝;
由工艺流程可知,气体D含有F元素,应是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水;
电解氧化铝生成铝和氧气,阳极发生氧化反应.
解答 解:(1)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3=2NaAlO2+H2O,
故答案为:2NaOH+SiO2=Na2SiO3+H2O;2NaOH+Al2O3=2NaAlO2+H2O;
(2)偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠,反应方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由工艺流程可知,气体D含有F元素,应是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O,
故答案为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
(4)电解氧化铝得到铝和氧气,阳极上氧离子失去电子发生氧化反应,电极反应式:2O2--4e-=O2↑;
故答案为:2O2--4e-=O2↑.
点评 本题为工艺流程题,考查了铝的制备,理解工艺流程、熟悉相关物质的性质是解题的关键,侧重考查化学方程式、离子方程式的书写,题目难度中等.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋 | |
| C. | 二氧化硅可用于制备太阳能电池板 | |
| D. | 装饰材料释放的甲醛会造成污染 |
| A. | 以NaOH溶液为电解液时,负极反应为Al+3OH--3e-═Al(OH)3↓ | |
| B. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-═4OH- | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
| A. | 丁醇 | B. | 丁烯 | C. | 一氯戊烷 | D. | 己烷 |
| A. | 浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铁钝化 | |
| B. | 浓硫酸与蔗糖混合搅拌产生刺激性气味气体,此过程只体现了浓硫酸的脱水性 | |
| C. | 某溶液中加盐酸产生使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32- 或SO32- | |
| D. | 某溶液中滴加BaCl2.溶液产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42- |
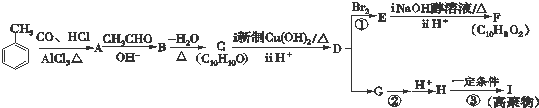

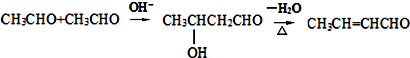
 .
.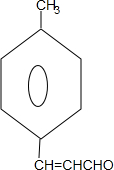 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$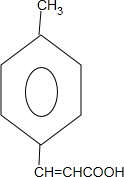 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.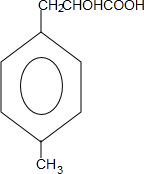 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$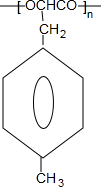 +nH2O.
+nH2O.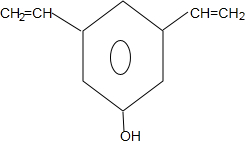
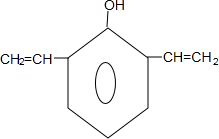 .
.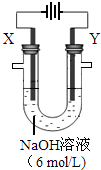 A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答:
A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答: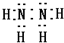 .
.