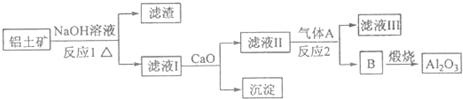
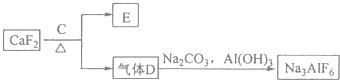
题目内容
19. A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答:
A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答:(1)B元素在周期表中的位置是第三周期ⅥA族;写出D、E两种元素组成的化合物D2E4的电子式:
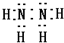 .
.(2)若将A金属投入到盐酸中,生成了浅绿色溶液N.N的酸性溶液与E2C2反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
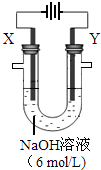
(3)以A构成的单质为Y极,碳棒为X极,在6mol/L的NaOH溶液中进行电解,制取高效净水剂Na2AO4(溶液呈紫红色).其装置如图.电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,且Y电极变细;电解液澄清.Y极发生的电极反应为:4OH--4e-═2H2O+O2↑和Fe-6e-+8OH-=FeO42-+4H2O.若在X极收集气体672mL,在Y极收集气体168mL(均已折算为标况下体积),则Y电极质量减少0.28g.
分析 A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,则D为O元素;D、E组成的气态化合物M的水溶液呈碱性,则D为N元素、E为H元素,M为NH3,B的单质在C2中燃烧产物可使品红溶液褪色,则B为S元素;A是一种历史悠久、应用广泛的金属元素,则A为Fe.
解答 解:A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,则D为O元素;D、E组成的气态化合物M的水溶液呈碱性,则D为N元素、E为H元素,M为NH3,B的单质在C2中燃烧产物可使品红溶液褪色,则B为S元素;A是一种历史悠久、应用广泛的金属元素,则A为Fe.
(1)B为S元素,在周期表中的位置是:第三周期ⅥA族,D、E两种元素组成的化合物N2H4的电子式: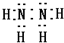 ,
,
故答案为:第三周期ⅥA族;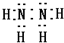 ;
;
(2)若将Fe金属投入到盐酸中,生成了浅绿色溶液N为氯化亚铁.氯化亚铁的酸性溶液与H2O2反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)以Fe构成的单质为Y极,碳棒为X极,在6mol/L的NaOH溶液中进行电解,制取高效净水剂Na2FeO4(溶液呈紫红色).电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,说明Y极上氢氧根离子放电生成氢气,Fe放电生成FeO42-,Y极发生的电极反应为:4OH--4e-═2H2O+O2↑和Fe-6e-+8OH-=FeO42-+4H2O,若在X极收集气体为氢气,其物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,在Y极收集氧气为$\frac{0.168L}{22.4L/mol}$=0.0075mol,根据电子转移守恒,则Y电极溶解的Fe为$\frac{0.03mol×2-0.0075mol×4}{6}$=0.005mol,则Y电极质量减少为0.005mol×56g/mol=0.28g,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;0.28.
点评 本题考查元素化合物推断、电解原理等,需要学生熟练掌握元素化合物知识,(3)注意利用电子转移守恒计算,难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 标准状况下,2.24L水所含的分子数目为0.1 NA | |
| B. | 9g水中含有的电子数目为0.5NA | |
| C. | 0.3 mol/L的MgCl2溶液中含Mg2+数目为0.3 NA | |
| D. | 常常压下,28gN2和CO混合气体中所含有的原子数目为2NA |
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 打磨磁石制作指南针为化学变化 |
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| C. | 酒精灯着火时可用湿布扑灭 | |
| D. | 蒸馏时,温度计水银球应浸没在液体中 |
| A. | 二氧化碳 | B. | 次氯酸的结构式 H-Cl-O | ||
| C. | 铝离子的结构示意图 | D. | 基态碳原子的价电子排布图为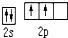 |
 具有的官能团有酯基和羧基(写名称).用阿司匹林和氢氧化钠中和制得可溶性阿司匹林,该反应的化学方程式为C6H5OOCCH3COOH+H2O→CH3COOH+C6H5OHCOOH.
具有的官能团有酯基和羧基(写名称).用阿司匹林和氢氧化钠中和制得可溶性阿司匹林,该反应的化学方程式为C6H5OOCCH3COOH+H2O→CH3COOH+C6H5OHCOOH.