题目内容
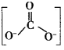
【题目】油酸甘油酯(相对分子质量884)是一种典型的脂肪,在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)。已知要消耗1kg该化合物,常人需快走约200公里(每快走1公里按平均耗能190 kJ计)。则油酸甘油酯的燃烧热△H约为( )
A.3.8×104kJ·mol-1B.-3.8×104kJ·mol-1
C.3.4×104kJ·mol-1D.-3.4×104kJ·mol-1
【答案】D
【解析】
燃烧热指的是燃烧1mol可燃物生成稳定的氧化物所放出的热量。燃烧1kg油酸甘油酯释放出热量3.8×104kJ,则1kg该化合物的物质的量为![]() ,则油酸甘油酯的燃烧热△H=-
,则油酸甘油酯的燃烧热△H=-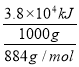 =-3.4×104kJmol-1;
=-3.4×104kJmol-1;
答案选D。

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
【题目】中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )
世界最大射电望远镜“中国天眼” |
“嫦娥四号”月球探测器 |
中国大飞机C919 |
中国第一艘深海载人潜水器“蛟龙号” |
A.光导纤维传输线 | B.晶体硅芯片 | C.新型铝锂合金机翼 | D.氮化硅陶瓷发动机 |
A.AB.BC.CD.D