题目内容
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__。(已知CO32-的结构式为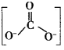 )
)
③NaNT可以![]() (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol![]() 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__。
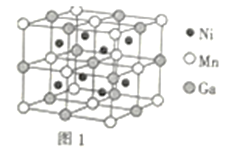
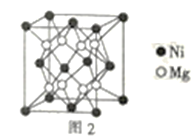
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___。晶胞中离1个Mn原子最近的Ni原子有__个。
(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__(列出计算表达式,NA表示阿伏加德罗常数的数值)gcm-3。
【答案】[Ar]3d6(或1s22s22p63s23p63d6) Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备半充满结构,因此Fe3+氧化性比Co3+弱 正四面体 N和O sp和sp2 9mol N2H4与H2O之间可以形成氢键 Ni2MnGa 8 ![]()
【解析】
(1)基态Fe的电子排布式为[Ar]3d64s2(或1s22s22p63s23p63d64s2),则基态Fe2+的核外电子排布式为[Ar]3d6(或1s22s22p63s23p63d6)。利用价电子排布式判断价电子层是否达稳定状态,可得出Fe3+比Co3+氧化性弱的原因是Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备半充满结构,因此Fe3+氧化性比Co3+弱。 (2)①ClO4-中,Cl的价层电子对数为4,且不存在孤对电子,由此可推出空间构型为正四面体。答案为:正四面体;
②CTCN的化学式为[Co(NH3)4CO3]NO3,配体为NH3和CO32-,则与Co3+形成配位键的原子为N和O。答案为:N和O;
③从双聚氰胺的结构中,能得出碳原子的价层电子对数为2和3,则杂化轨道类型为sp和sp2;两个原子间只能形成1个σ键,由结构可确定1mol![]() 中含有σ键的物质的量为9mol。答案为:sp和sp2;9mol;
中含有σ键的物质的量为9mol。答案为:sp和sp2;9mol;
④配体N2H4能与水混溶,除因为它们都是极性分子外,还因为N2H4与H2O之间可以形成氢键。答案为:N2H4与H2O之间可以形成氢键;
(3)晶胞中,Ni原子位于每个小立方体的体心,则晶胞中所含Ni原子个数为8;Mn原子位于顶点和面心,则晶胞中所含Mn原子个数为8×![]() +6×
+6×![]() =4;Ga原子位于体心和棱上,则晶胞中所含Ga原子个数为1+12×
=4;Ga原子位于体心和棱上,则晶胞中所含Ga原子个数为1+12×![]() =4,则化学式为Ni2MnGa。晶胞中,Mn原子在面心,而Ni原子在小立方体的体心,则晶胞中离1个Mn原子最近的Ni原子有8个。答案为:Ni2MnGa;8;
=4,则化学式为Ni2MnGa。晶胞中,Mn原子在面心,而Ni原子在小立方体的体心,则晶胞中离1个Mn原子最近的Ni原子有8个。答案为:Ni2MnGa;8;
(4)每个面的两条相交的棱的中点连线即为“距离最近的两个H2分子之间的距离为anm”,设立方体的边长为x,则a2=(![]() )2+(
)2+(![]() )2,从而求出x=
)2,从而求出x=![]() nm。每个晶胞中含有4个NiMg2,则可求出镍镁晶体未储氢时的密度为
nm。每个晶胞中含有4个NiMg2,则可求出镍镁晶体未储氢时的密度为![]() =
=![]() g/cm3。答案为:
g/cm3。答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
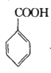
小学生10分钟应用题系列答案【题目】苯甲酰氯(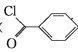 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
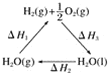
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 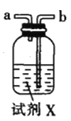 乙.
乙. 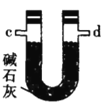 丙.
丙. 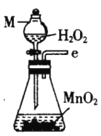 丁.
丁. 戊.
戊. 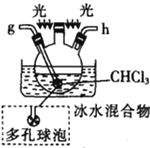
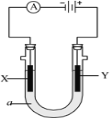
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
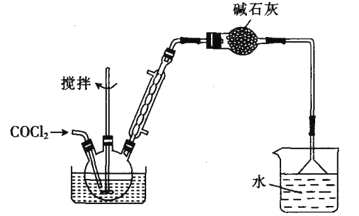
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。