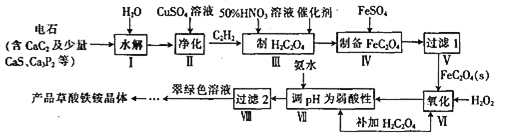
Ő‚ńŅńŕ»›
°ĺŐ‚ńŅ°Ņľ◊Õť «Őž»Ľ∆ÝĶń÷ų“™≥…∑÷£¨ «“Ľ÷÷÷ō“™Ķń«ŚĹŗń‹‘īļÕĽĮĻ§‘≠ŃŌ°£
£®1£©”√√ļ÷∆Őž»Ľ∆Ý ĪĽŠ∑Ę…ķ∂ŗłŲ∑ī”¶£¨Õ®Ļż∂ŗ÷÷Õĺĺ∂…ķ≥…CH4°£
“—÷™£ļC£®s£© ģ2H2£®g£© ![]() CH4£®g£© °ųH=£≠73kJ/mol
CH4£®g£© °ųH=£≠73kJ/mol
2CO£®g£© ![]() C£®s£©+CO2£®g£© °ųH=£≠171kJ/mol
C£®s£©+CO2£®g£© °ųH=£≠171kJ/mol
CO£®g£© ģ3H2£®g£© ![]() CH4£®g£©+H2O£®g£© °ųH=£≠203kJ/mol°£
CH4£®g£©+H2O£®g£© °ųH=£≠203kJ/mol°£
–ī≥ŲCO£®g£© ”ŽH2O£®g£© ∑ī”¶…ķ≥…H 2£®g£© ļÕCO2£®g£© Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺ____________°£
£®2£©Őž»Ľ∆Ý÷–ļ¨”–H2S‘”÷ £¨ń≥Ņ∆—––°◊ť”√įĪňģőŁ ’Ķ√ĶĹNH4HS»‹“ļ£¨“—÷™T°śk£®NH3°§H2O£© =1.74°Ń10£≠5£Ľ k1£®H2S£© =1.07°Ń10£≠7£¨ k2£®H2S£© =1.74°Ń10£≠13£¨NH4HS»‹“ļ÷–ňýļ¨Ń£◊”Ň®∂»īů–°ĻōŌĶ’ż»∑Ķń «____________°£
A c£®NH4+£©>c£®HS£≠£©>c£®OH£≠£© >c£®H+£©
B c£®HS£≠£© > c£®NH4+£©> £®S2£≠£© >c£®H+£©
C c£®NH4+£©>c£®HS£≠£© >c£®H2S£© >c£®H+£©
D c£®HS£≠£© >c£®S2£≠£© >c£®H+£©>c£®OH£≠£©
£®3£©Ļ§“Ķ…Ō≥£”√CH4”Žňģ’Ű∆Ý‘ŕ“Ľ∂®ŐűľĢŌ¬ņī÷∆»°H2£¨∆š‘≠ņŪő™£ļ CH4£®g£©+H2O£®g£© ![]() CO£®g£©+3H2£®g£©
CO£®g£©+3H2£®g£©
ĘŔ“Ľ∂®ő¬∂» Ī£¨ ‘ŕ“ĽłŲŐŚĽżő™2LĶńļ„»›√‹Ī’»›∆ų÷–£¨ ľ”»Ž1molCH4ļÕ1.4molňģ’Ű∆Ý∑Ę…ķ…Ō Ų∑ī”¶£¨ 5minļůīÔ∆Ĺļ‚£¨ …ķ≥…0.2mol CO£¨ ”√H2ĪŪ ĺł√∑ī”¶ĶńňŔ¬ ő™____________°£īň∑ī”¶Ķń∆Ĺļ‚≥£ żő™____________£®ĹŠĻŻĪ£ŃŰĶĹ–° żĶ„ļů»żőĽ£©°£
ĘŕŌ¬Ń–ňĶ∑®÷–ń‹ňĶ√ųīň∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨Ķń «____________°£
A ŐŚŌĶĶń—Ļ«Ņ≤Ľ‘Ŕ∑Ę…ķĪšĽĮ
B …ķ≥…1molCH4ĶńÕ¨ ĪŌŻļń3molH2
C łų◊ť∑÷ĶńőÔ÷ ĶńŃŅŇ®∂»≤Ľ‘ŔłńĪš
D ŐŚŌĶĶń√‹∂»≤Ľ‘Ŕ∑Ę…ķĪšĽĮ
E ∑ī”¶ňŔ¬ V£®CH4£©£ļV£®H2O£©£ļu£®CO£©£ļu£®H2£©=1£ļ1£ļ1£ļ3
£®4£©ľ◊īľňģ’Ű∆Ý÷ō’Ż÷∆«‚∑ī”¶£ļCH3OH£®g£©+H2O£®g£©=CO2£®g£©+3H2£®g£© ¶§H=+49kJ/mol°£ń≥ő¬∂»Ō¬£¨ Ĺę[n£®H2O£© £ļn£®CH3OH£© ] =1£ļ1Ķń‘≠ŃŌ∆Ý≥š»Žļ„»›√‹Ī’»›∆ų÷–£¨≥ű ľ—Ļ«Ņő™p1£¨∑ī”¶īÔĶĹ∆Ĺļ‚ Ī◊‹—Ļ«Ņő™p2£¨‘Ú∆Ĺļ‚ Īľ◊īľĶń◊™ĽĮ¬ ő™____________°£
°ĺīūįł°ŅCO(g)+H2O(g)=H2(g)+CO2(g) °ųH=41 kJmol1 ac 0.06 molL1min1 0.011 AC ![]()
°ĺĹ‚őŲ°Ņ
ĘŇC(s)+2H2(g)CH4(g) °ųH=73 kJmol1ĘŔ£Ľ2CO(g) C(s)+CO2(g) °ųH=171 kJmol1Ęŕ£ĽCO(g) +3H2(g)CH4(g)+H2O(g) °ųH=203 kJmol1ĘŘ£ĽĹę∑Ĺ≥Ő ĹĘŔ+ĘŕĘŘĶ√CO(g)+H2O(g)=H2(g)+CO2(g)£¨ž ĪšĹÝ––Ōŗ”¶ĶńłńĪš°£
Ę∆łýĺ›ĶÁņŽ∆Ĺļ‚≥£ ż÷™£¨“ĽňģļŌįĪĶÁņŽ≥Ő∂»īů”ŕŃÚĽĮ«‚ĶÁņŽ≥Ő∂»£¨ňý“‘NH4HS»‹“ļÔßłýņŽ◊”ňģĹ‚≥Ő∂»–°”ŕHS£≠ňģĹ‚≥Ő∂»£¨»‹“ļ≥ ľÓ–‘£¨‘Úc(OH£≠)> c(H+)£¨ĶęÔßłýņŽ◊”ļÕŃÚĽĮ«‚ņŽ◊”ňģĹ‚≥Ő∂»∂ľĹŌ–°£ĽŃÚ«‚łýņŽ◊”ňģĹ‚≥Ő∂»īů”ŕ∆šĶÁņŽ≥Ő∂»°£
Ę«ĘŔłýĺ›»ż∂ő Ĺņīľ∆ň„£ĽĘŕA£ģ∑ī”¶īÔ∆Ĺļ‚÷ģ«į£¨ŐŚŌĶĶń—Ļ«Ņ‘ŕ÷ūĹ•‘Ųīů£ĽB£ģ…ķ≥…1molCH4 Ī“Ľ∂®Õ¨ ĪŌŻļń3mol H2£ĽC£ģ‘ŕ∑ī”¶īÔ∆Ĺļ‚÷ģ«į£¨łų◊ť∑÷ĶńőÔ÷ ĶńŃŅŇ®∂»‘ŕĪš£ĽD£ģīň∑ī”¶ «łŲ∆ÝŐŚĶń÷ ŃŅļÕŐŚĽż≤ĽĪšĶń∑ī”¶£ĽE£ģ∑ī”¶ňŔ¬ V(CH4)£ļV(H2O)£ļv(CO)£ļv(H2)=1£ļ1£ļ1£ļ3ļ„≥…ŃĘ°£
Ę»ļ„ő¬ļ„»›Ō¬£¨∆ÝŐŚĶń—Ļ«Ņ÷ģĪ»Ķ»”ŕ∆šőÔ÷ ĶńŃŅ÷ģĪ»£¨ľ∆ň„∆Ĺļ‚ Ī∆ÝŐŚĶń◊‹őÔ÷ ĶńŃŅ£¨‘ŔņŻ”√≤ÓŃŅ∑®ľ∆ň„≤őľ”∑ī”¶ľ◊īľĶńőÔ÷ ĶńŃŅ£¨ĹÝ∂Ýľ∆ň„ľ◊īľĶń◊™ĽĮ¬ °£
ĘŇC(s)+2H2(g)CH4(g) °ųH=73kJmol1ĘŔ£Ľ2CO(g) C(s)+CO2(g) °ųH=171 kJmol1Ęŕ£ĽCO(g) +3H2(g)CH4(g)+H2O(g) °ųH=203 kJmol1ĘŘ£ĽĹę∑Ĺ≥Ő ĹĘŔ+ĘŕĘŘĶ√CO(g)+H2O(g)=H2(g)+CO2(g) °ųH=(73 kJmol1)+(171 kJmol1)(203 kJmol1)=41 kJmol1£ĽĻ īūįłő™£ļCO(g)+H2O(g)=H2(g)+CO2(g) °ųH=41 kJmol1°£
(2)łýĺ›ĶÁņŽ∆Ĺļ‚≥£ ż÷™£¨“ĽňģļŌįĪĶÁņŽ≥Ő∂»īů”ŕŃÚĽĮ«‚ĶÁņŽ≥Ő∂»£¨ňý“‘NH4HS»‹“ļÔßłýņŽ◊”ňģĹ‚≥Ő∂»–°”ŕHSňģĹ‚≥Ő∂»,»‹“ļ≥ ľÓ–‘£¨‘ÚcOH)>c(H+)£¨ĶęÔßłýņŽ◊”ļÕŃÚĽĮ«‚ņŽ◊”ňģĹ‚≥Ő∂»∂ľĹŌ–°£¨ňý“‘ņŽ◊”Ň®∂»īů–°ň≥–Ú «c(NH4+4)>c(HS)>c(OH)>c(H+)£¨ŃÚ«‚łýņŽ◊”ňģĹ‚≥Ő∂»īů”ŕ∆šĶÁņŽ≥Ő∂»£¨ňý“‘ĽĻīś‘ŕc(NH4+4)>c(HS)>c(OH)>c(H+)°£Ļ —°ac°£
(3)ĘŔ‘ŕ“ĽłŲŐŚĽżő™2LĶńļ„»›√‹Ī’»›∆ų÷–£¨ľ”»Ž1molCH4ļÕ1.4molňģ’Ű∆Ý∑Ę…ķ…Ō Ų∑ī”¶£¨5sļůīÔ∆Ĺļ‚£¨…ķ≥…0.2molCO£¨łýĺ›»ż∂ő ĹŅ…”–£ļ
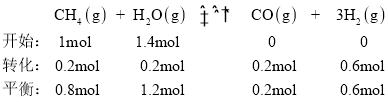
‘Ú”√H2ĪŪ ĺł√∑ī”¶ĶńňŔ¬ ő™![]() £Ľīň∑ī”¶Ķń∆Ĺļ‚≥£ ż
£Ľīň∑ī”¶Ķń∆Ĺļ‚≥£ ż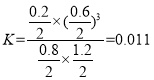 £ĽĻ īūįłő™£ļ0.06 molL1min1£Ľ0.011°£
£ĽĻ īūįłő™£ļ0.06 molL1min1£Ľ0.011°£
ĘŕĘŕA. ∑ī”¶īÔ∆Ĺļ‚÷ģ«į£¨ŐŚŌĶĶń—Ļ«Ņ‘ŕ÷ūĹ•‘Ųīů£¨Ļ ĶĪŐŚŌĶ—Ļ«Ņ≤ĽĪš Ī£¨∑ī”¶īÔ∆Ĺļ‚£¨Ļ A’ż»∑£ĽB. …ķ≥…1mol CH4 Ī“Ľ∂®Õ¨ ĪŌŻļń3mol H2£¨ «Īō»ĽĶńĻōŌĶ£¨≤Ľń‹◊ųő™∆Ĺļ‚ĶńĪÍ÷ĺ£¨Ļ BīŪőů£ĽC. ‘ŕ∑ī”¶īÔ∆Ĺļ‚÷ģ«į£¨łų◊ť∑÷ĶńőÔ÷ ĶńŃŅŇ®∂»‘ŕĪš£¨Ļ ĶĪłų◊ť∑÷ĶńŇ®∂»≤ĽĪš Ī£¨∑ī”¶īÔ∆Ĺļ‚£¨Ļ C’ż»∑£ĽD. īň∑ī”¶ «łŲ∆ÝŐŚĶń÷ ŃŅļÕŐŚĽż≤ĽĪšĶń∑ī”¶£¨Ļ ∆ÝŐŚĶń√‹∂»¶—=m°¬V(»›)£¨√‹∂»“Ľ÷Ī≤ĽĪš£¨Ļ ≤Ľń‹◊ųő™∆Ĺļ‚ĶńĪÍ÷ĺ£¨Ļ DīŪőů£ĽE. ∑ī”¶ňŔ¬ ¶‘(CH4):¶‘(H2O): ¶‘(CO): ¶‘(H2)=1:1:1:3ļ„≥…ŃĘ£¨”Ž∑ī”¶īÔ≤ĽīÔ∆Ĺļ‚√Ľ”–ĻōŌĶ£¨Ļ ≤Ľń‹◊ųő™∆Ĺļ‚ĶńĪÍ÷ĺ£¨Ļ EīŪőů£ĽĻ —°AC°£
(4)…Ť∆ū ľn(H2O)=n(CH3OH)=1mol£¨ļ„ő¬ļ„»›Ō¬£¨∆ÝŐŚĶń—Ļ«Ņ÷ģĪ»Ķ»”ŕ∆šőÔ÷ ĶńŃŅ÷ģĪ»£¨∆Ĺļ‚ Ī∆ÝŐŚĶń◊‹őÔ÷ ĶńŃŅ![]() £¨
£¨ £¨
£¨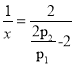 £¨Ĺ‚Ķ√
£¨Ĺ‚Ķ√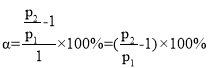 £¨Ļ īūįłő™£ļ
£¨Ļ īūįłő™£ļ![]() °£
°£

 Ņŕň„Ő‚Ņ®ľ””¶”√Ő‚ľĮ—ĶŌĶŃ–īūįł
Ņŕň„Ő‚Ņ®ľ””¶”√Ő‚ľĮ—ĶŌĶŃ–īūįł ◊ŘļŌ◊‘≤‚ŌĶŃ–īūįł
◊ŘļŌ◊‘≤‚ŌĶŃ–īūįł