题目内容
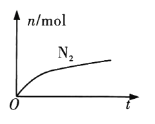
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
【答案】D
【解析】
由曲线变化图可知,随反应进行N2的物质的量增大,故N2是生成物,则NH4+应是反应物,N元素化合价升高,则具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则根据原子守恒、电子守恒和电荷守恒可得反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题。
该反应方程式为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+。
A.由方程式可知:在反应中NH4+中N元素在反应后化合价升高,所以还原剂为NH4+,A错误;
B.N元素化合价由-3价升高到0价,则消耗1mol还原剂,转移3mol电子,B错误;
C.由方程式可知氧化剂是ClO-,还原剂是NH4+,氧化剂与还原剂的物质的量之比为3:2,C错误;
D.反应生成H+,使溶液中c(H+)增大,溶液酸性增强,D正确;
故合理选项是D。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
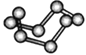
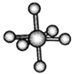
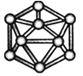
| HCN | S8 | SF6 | B12结构单元 |
结构模型示意图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | 熔点1873 K |
A. HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键
B. 固态硫S8属于原子晶体,分子中S原子采用sp3杂化
C. SF6是由极性键构成的非极性分子,分子构型为八面体型
D. 单质硼属于原子晶体
【题目】某小组用实验 1验证FeCl3与 Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
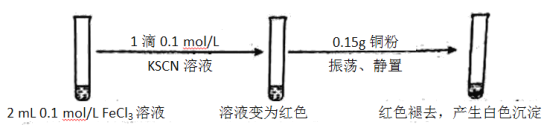
资料:ⅰ. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42—、Cu2+与Cl—。
ⅱ. SCN—被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与溴单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________。
(2)下列由实验1得到的推论中,合理的是__________。(填字母序号)
a.Cu能还原Fe3+
b.Fe3+与SCN—的反应是可逆反应
c.白色沉淀中的Cu(Ⅰ)(Ⅰ表示+1 价铜元素)可能是由 Fe3+氧化Cu 得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
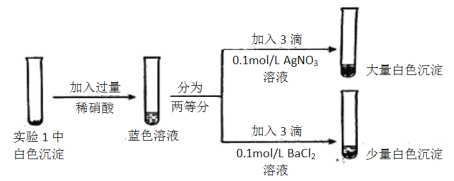
由实验2可知,实验1中白色沉淀的成分是__________。
(4)该小组欲进一步探究实验 1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 向2mL 0.1mol/L的FeCl3溶液中加入0.15g Cu粉 | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 |
Ⅱ | 取Ⅰ中上层清液于试管中,滴加 1滴 0.1mol/L KSCN溶液 | 有白色沉淀生成,且溶液出现红色 |
Ⅲ | 振荡Ⅱ中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤Ⅰ中反应的离子方程式为___________________。
②根据实验 3 的现象,小组同学认为 Fe3+与Cu 反应的氧化产物不含Cu(Ⅰ),他们的判断依据是_______________________________。
③步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是______________。
④解释步骤Ⅲ中实验现象产生的可能原因:___________。
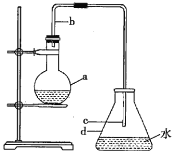
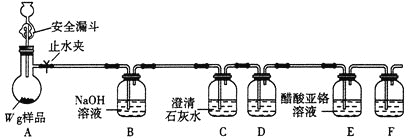
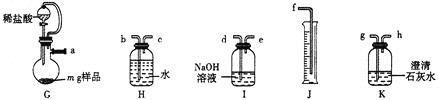
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种氧化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
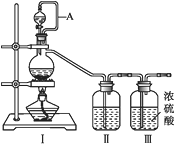
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ① | ② |
制备纯净NO | Cu | ③ | ④ |
②___________,③___________。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→___________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅶ的作用为________________,若无该装置,Ⅸ中NOCl可能发生反应的化学方程式为_______________________________。
③乙组同学认为氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,所以装置Ⅷ不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是__________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为___________________。
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度
取Ⅸ中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。
②若滴定前,滴定管尖嘴有气泡,滴定后气泡消失,则所测亚硝酰氯的纯度_________(偏高、偏低、无影响)