题目内容
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1,其第二电离能增幅较大的原因是__________________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、___________、[Cr(NH3)4Cl2]Cl·2NH3。
(5)NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。在VSEPR模型中NH4+的几何构型名称为______________。
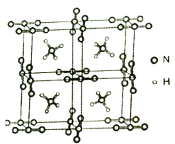
(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为_________________g·cm-3。
【答案】2s22p3 0.5NA NA N>O>C O失去1个电子后,2p轨道有3个电子,为半充满状态,较为稳定 离子键 [Cr(NH3)5Cl]Cl2·NH3 sp 正四面体 ![]()
【解析】
=1,NH4+为1个,由此可求出1个小立方体的质量及体积,从而求出NH4N3的密度。
(1)氮原子的电子排布式为1s22s22p3,则基态氮原子的价电子排布式为2s22p3。答案为:2s22p3;
(2)14g氮气为0.5mol,1个氮气分子中含有1个σ键、2个π键,其中以“头碰头”方式形成的共价键为σ键,数目为0.5NA,以“肩并肩”方式形成的共价键为π键,数目为NA。答案为:0.5NA;NA;
(3)C、N、O属于同周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,但N由于2p轨道半充满而出现反常,其第一电离能大于O,所以三种元素按第一电离能从大到小的排列顺序为N>O>C。氧的第二电离能增幅较大,应从2p轨道的电子排布情况进行分析,其原因是O失去1个电子后,2p轨道有3个电子,为半充满状态,较为稳定。答案为:N>O>C;O失去1个电子后,2p轨道有3个电子,为半充满状态,较为稳定;
(4)某含氨配合物CrCl3·6NH3为离子化合物,化学键类型有配位键、极性共价键和离子键。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、[Cr(NH3)5Cl]Cl2·NH3、[Cr(NH3)4Cl2]Cl·2NH3。答案为:离子键;[Cr(NH3)5Cl]Cl2·NH3;
(5)N3-是直线型结构,其与CO2为等电子体,则N3-中氮原子的杂化类型是sp。在VSEPR模型中NH4+的价层电子对数为4,则几何构型名称为正四面体。答案为:sp;正四面体;
(6)由晶胞结构可知,1个晶胞分为8个小立方体,每个小立方体中,含N3-的个数为8×![]() =1,NH4+为1个,1个小立方体的质量为
=1,NH4+为1个,1个小立方体的质量为![]() g,阿伏加德罗常数的值为NA,则NH4N3的密度为
g,阿伏加德罗常数的值为NA,则NH4N3的密度为 =
= ![]() g·cm-3。答案为:
g·cm-3。答案为:![]() 。
。