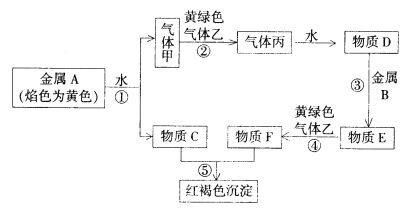
题目内容
【题目】在一个密闭容器中发生如下反应:2SO2(g) + O2(g) ![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(SO2)=0.25 mol·L-1D. c(SO2) + c(SO3)=0.5 mol·L-1
【答案】C
【解析】
反应过程中某一时刻测得SO2,O2,SO3的浓度分别为:0.2molL-1,0.2molL-1,0.2molL-1,假设二氧化硫和氧气转化为三氧化硫,当二氧化硫完全转化时,氧气有0.1mol/L的转化,生成0.2mol/L三氧化硫,此时c(SO2)=0、c(O2)=0.1mol/L、c(SO3)=0.4mol/L;
假设三氧化硫完全转化为二氧化硫和氧气,则c(SO2)=0.4mol/L、c(O2)=0.3mol/L、c(SO3)=0mol/L,实际上存在平衡状态,所以存在0<c(SO2)<0.4mol/L、0.1mol/L<c(O2)<0.3mol/L、0<c(SO3)<0.4mol/L。
A.c(SO3)=0.4 mol·L-1,不满足0<c(SO3)<0.4mol/L,故A错误;
B.c(SO2)=c(SO3)=0.15 mol·L-1,c(SO2)、c(SO3)不可能都减小,故B错误;
C.c(SO2)=0.25 mol·L-1,满足0<c(SO2)<0.4mol/L,故C正确;
D.根据方程式2SO2(g) + O2(g) ![]() 2SO3(g),c(SO2) + c(SO3)=0.4 mol·L-1,故D错误;
2SO3(g),c(SO2) + c(SO3)=0.4 mol·L-1,故D错误;
故选C。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案