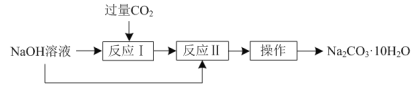
��Ŀ����
����Ŀ����ҵ����������(��Ҫ�ɷ�ΪAl2O3��Fe2O3��SiO2)��ȡ��������ұ������ԭ�ϣ���ȡ�IJ����������£�

��ش��������⣺
(1)�����ٵ����ƣ�____________��
(2)�����ڵĻ�ѧʽ��____________��
(3)д����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��__________��
(4)д����Һ����ͨ�����CO2�����ɳ��������ӷ���ʽ�� ______���ܷ���Һ����ͨ�����CO2���ɼ��������� ____ (����������)����������_______(�û�ѧ����ʽ��ʾ)��
����ˮAlCl3���������������л��ϳɵĴ����ȡ���ҵ����������Ϊԭ���Ʊ���ˮAlCl3�Ĺ����������£�

(1)���ڿ������н�ǿ�Ŀ���ʴ�ԣ�ԭ����___________________________��
(2)�Ȼ�¯��Al2O3��Cl2��C��Ӧ�Ļ�ѧ����ʽΪ___________________________��
(3)Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ(������FeCl3)�Ĵ��ȣ���ȡ16g��ˮAlCl3��Ʒ���ڹ�����NaOH��Һ�У����˳�����������ᆳϴ�ӡ����ա���ȴ�����أ���������Ϊ0.32g��
��д���������ӹ������漰�����ӷ���ʽ______________��_______________��
�ڲ�Ʒ��AlCl3����������Ϊ___________��(������λ��Ч����)
���𰸡����� Fe(OH)3 SiO2+2NaOH=Na2SiO3+H2O ![]() +CO2+2H2O=Al(OH)3��+
+CO2+2H2O=Al(OH)3��+![]() ���� Al(OH)3 +3HCl= AlCl3 +3H2O ���ڿ����л��γ�һ�����ܵ�����Ĥ����ֹ���һ������ Al2O3+3Cl2+3C
���� Al(OH)3 +3HCl= AlCl3 +3H2O ���ڿ����л��γ�һ�����ܵ�����Ĥ����ֹ���һ������ Al2O3+3Cl2+3C![]() 2AlCl3+3CO Fe3++3OH-=Fe(OH)3�� Al3++4OH=
2AlCl3+3CO Fe3++3OH-=Fe(OH)3�� Al3++4OH=![]() +2H2O 96%
+2H2O 96%
��������
�������̿�֪�������ᣬֻ��SiO2����Ӧ�����������������������ᷴӦ��������Ϊ���ˣ�������ΪSiO2����Һ���мӹ���NaOH��������ת��Ϊƫ�����ƣ�������ת�����������˺�����ΪFe(OH)3����Һ�ں�NaOH��ƫ�����ƣ��������̼��Ӧ��������������̼�����ƣ�������������ֽ��������������Դ������
���ݹ������̿�֪�Ȼ�¯�IJ������ȴ���������Ʊ���ˮAlCl3��˵���Ȼ�¯�IJ����к���A1C13��������β������CO������Al2O3��C12��C��Ӧ������A1C13��CO��A1C13Ϊ���ۻ��������������Ҫ����AlCl3��FeCl3��FeCl3�۵㡢�е�ϸߣ������Ʊ���ˮAlCl3����������AlĿ���dz�ȥFeCl3��
��(1)������������֪�������ٵ����ƣ����ˣ�
(2) ������������֪�������ڵĻ�ѧʽΪFe(OH)3��
(3)��������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪSiO2+2NaOH=Na2SiO3+H2O��
(4) ��Һ�ں�NaOH��ƫ�����ƣ�ͨ�����CO2���壬����Al(OH)3������NaHCO3�������ɳ��������ӷ���ʽΪ![]() +CO2+2H2O=Al(OH)3��+
+CO2+2H2O=Al(OH)3��+![]() ��Al(OH)3�������������������ǿ���ǿ����Һ������Һ��������������ᣬ����Al(OH)3�������ɣ�������Ӧ�Ļ�ѧ����ʽΪAl(OH)3 +3HCl= AlCl3 +3H2O���ʲ����ù�������������CO2���壻
��Al(OH)3�������������������ǿ���ǿ����Һ������Һ��������������ᣬ����Al(OH)3�������ɣ�������Ӧ�Ļ�ѧ����ʽΪAl(OH)3 +3HCl= AlCl3 +3H2O���ʲ����ù�������������CO2���壻
��(1) ���ڿ����л��γ�һ�����ܵ�����Ĥ����ֹ���һ��������˵�����ڿ������н�ǿ�Ŀ���ʴ������
(2) ���ݹ������̿�֪�Ȼ�¯�IJ������ȴ���������Ʊ���ˮAlCl3��˵���Ȼ�¯�IJ����к���A1C13��������β������CO������Al2O3��C12��C��Ӧ������A1C13��CO����Ӧ����ʽΪAl2O3+3Cl2+3C![]() 2AlCl3+3CO��
2AlCl3+3CO��
(3) �ٳ��ӹ����������������������ӽ�ϳ��������������������������������ӽ�ϳ�ƫ�������ˮ��������Ӧ�����ӷ���ʽΪFe3++3OH-=Fe(OH)3����Al3++4OH-=AlO2-+2H2O��
��0.32g����ɷ�ΪFe2O3�������ʵ���Ϊ![]() =0.002mol������ԭ���غ㣬��֪������FeCl3�����ʵ���Ϊ0.005mol�����Ʒ��AlCl3����������Ϊ
=0.002mol������ԭ���غ㣬��֪������FeCl3�����ʵ���Ϊ0.005mol�����Ʒ��AlCl3����������Ϊ![]() ��96%��
��96%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�