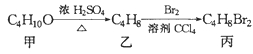题目内容
【题目】下列反应的离子方程式正确的是( )。
A.用浓盐酸与二氧化锰反应制取少量氯气:MnO2+4HCl![]() Mn2+ + 2Cl-+ Cl2↑+2H2O
Mn2+ + 2Cl-+ Cl2↑+2H2O
B.在NaHCO3溶液中滴加少量Ca(OH)2:![]() + Ca2+ + OH═ CaCO3↓+ H2O
+ Ca2+ + OH═ CaCO3↓+ H2O
C.氯气与水反应:Cl2 + H2O ═ 2H+ + Cl- +ClO-
D.NaClO溶液中通入少量的SO2:3ClO﹣+H2O+SO2═Cl﹣+![]() +2HClO
+2HClO
【答案】D
【解析】
A. 浓盐酸可以拆,正确的离子方程式为:MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2↑+2H2O,故A错误;
Mn2+ + Cl2↑+2H2O,故A错误;
B. 在NaHCO3溶液中滴加少量Ca(OH)2,假设Ca(OH)2为1mol,则2mol氢氧根离子消耗2mol碳酸氢根离子,生成2mol碳酸根离子和2mol水,1mol钙离子结合1mol碳酸根离子生成1mol碳酸钙沉淀,正确的离子方程式为:2HCO3- +Ca2+ + 2OH- = CaCO3↓+ CO32-+ 2H2O,故B错误;
C. 次氯酸为弱酸,不能拆,且该反应为可逆反应,正确的离子方程式为:Cl2 + H2OH+ + Cl- +HClO,故C错误;
D. NaClO溶液中通入少量的SO2中,发生氧化还原反应,生成氯离子和硫酸根离子,由于次氯酸钠溶液显碱性,故该反应的离子方程式为3ClO﹣+H2O+SO2═Cl﹣+![]() +2HClO,故D正确;
+2HClO,故D正确;
故选D。

【题目】某校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____。滴定终点的现象是____________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为____mL。

(4)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | |||
第1次 | 20.00 | 0.00 | 26.01 | |
第2次 | 20.00 | 1.56 | 30.30 | |
第3次 | 20.00 | 0.22 | 26.21 | |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)__