题目内容
【题目】将32g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体标准状况下的体积为11.2L,气体全部逸出后,向溶液中加入VmL n mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为 mol/L.(结果须化简)
【答案】(5+ ![]() )
)
【解析】解:向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3 , 由钠离子守恒n(NaNO3)=n(NaOH)=V×10﹣3L×nmol/L=nV×10﹣3mol,根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=nV×10﹣3mol+ ![]() =(nV×10﹣3+0.5)mol,故原有硝酸的物质的量浓度为
=(nV×10﹣3+0.5)mol,故原有硝酸的物质的量浓度为 ![]() =(5+
=(5+ ![]() )mol/L,
)mol/L,
所以答案是:(5+ ![]() ).
).

 名师伴你成长课时同步学练测系列答案
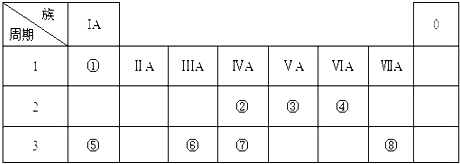
名师伴你成长课时同步学练测系列答案【题目】某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
(1)用A、B、O表示这类特殊晶体的化学式 . 在图中,与A原子配位的氧原子数目为 .
(2)基态Cr原子的核外电子排布式为 , 其中电子的运动状态有种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2 , N和O的基态原子中,未成对的电子数目比为 .
(4)下表是几种碳酸盐的热分解温度和阳离子半径
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
请解释碳酸钙热分解温度最低的原因: .
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm.又知钙的密度为1.54gcm﹣3 , 则1cm3钙晶体中含有个晶胞,阿伏伽德罗常数为(列式计算).