题目内容
【题目】在己经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种但与生产生活有密切的联
系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_________________。
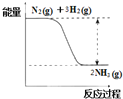
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①合成氨的反应中的能量变化如图所示.该反应是__________反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量__________(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
A. 容器中混合气体的密度不随时间变化 B. 断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)键性电池具有容量大、放电电流大的特点,固而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
则该电池的负极反应是_________,放电时,外电路中每通过0.2mol电子,锌的质量理论上减小______。
【答案】 C(s)+H2O(g) ![]() CO (g)+ H2(g) 放热 小于 BD Zn - 2e-+2OH-= Zn(OH)2 6. 5
CO (g)+ H2(g) 放热 小于 BD Zn - 2e-+2OH-= Zn(OH)2 6. 5
【解析】(1)C与水反应生成CO和氢气,反应为C(s)+H2O(g)![]() CO (g)+H2(g),故答案为:C(s)+H2O(g)
CO (g)+H2(g),故答案为:C(s)+H2O(g)![]() CO (g)+H2(g);
CO (g)+H2(g);
(2)①由图可知,反应物的总能量大于生成物的总能量,则该反应为放热反应,断裂化学键吸收能量,生成化学键释放能量,△H=断裂化学键吸收能量-生成化学键释放能量<0,可知断裂化学键吸收能量小于生成化学键释放能量,故答案为:放热;小于;
②A.体积不变,质量守恒,则密度始终不变,所以不能判断平衡状态,故A错误; B.断裂3mol H-H键,表示正速率,形成6mol N-H键表示正速率,都是正速率不能判断平衡状态,故B正确;C. N2、H2、NH3的物质的量之比为1:3:2,取决起始浓度与转化率,不能判断平衡状态,故C错误;D.该反应为反应前后气体物质的量不等的反应,则容器中的压强不随时间变化,可知反应达到平衡状态,故D正确;故选BD;
(3)电池负极为Zn,碱性条件下负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2,故答案为:Zn-2e-+2OH-═Zn(OH)2;由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则外电路中每通过0.2mol电子,锌的质量理论上减小6.5g,故答案为:D;6.5。