题目内容
【题目】下列关于物质的浓度的说法正确的是( )
A.将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液
B.500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl﹣)仍然是3mol/L(忽略混合后体积变化)
D.把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10%
【答案】D
【解析】解:A.将5.85 g NaCl固体溶于1 L水中,得到溶液体积大于1L,配成NaCl 溶液浓度小于0.1mol/L,故A错误;B.氢氧化钠为离子化合物,溶于水完全电离,所以溶液中不含有氢氧化钠分子,故B错误;
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的n(Cl﹣)=3mol/L×2×0.2L+3mol/L×0.1L=1.5mol,溶液中的c(Cl﹣)= ![]() =5mol/L,故C错误;
=5mol/L,故C错误;
D.100g20%的NaCl溶液中氯化钠质量为20g,稀释中溶质的质量不变,溶液质量变为原来2倍,为200g,所以混合后,NaCl溶液的质量分数是10%,故D正确;
故选D.

【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1= .
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:>>
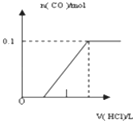
(3)①如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是(填化学式).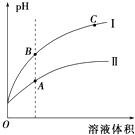
②a、b、c三点中,水的电离程度最大的是(填字母).