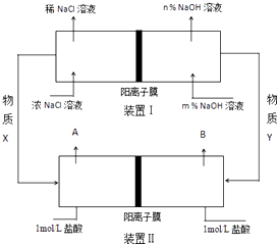
题目内容
【题目】用括号中的试剂除去各组物质中的杂质,可选试剂不正确的是( )
A.乙醇中的水(新制CaO)
B.乙烷中乙烯(溴水)
C.苯中的甲苯(溴水)
D.乙酸乙酯中的乙酸(饱和Na2CO3溶液)
【答案】C
【解析】解:A.CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故A正确; B.乙烯与溴水反应,而乙烷不能,洗气可分离,故B正确;
C.溴、甲苯均易溶于苯,不能除杂,应选高锰酸钾、分液,故C错误;
D.乙酸与碳酸钠反应后,与乙酸乙酯分层,然后分液可分离,故D正确;
故选C.

【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
化学式 | HF | H2CO3 | HClO |
电离平衡常数(Ka) | 7.2×10﹣4 | K1=4.4×10﹣7 | 3.0×10﹣8 |
(1)将浓度为0.1molL﹣1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是 .
A.c(H+)
B.c(H+)c(OH﹣)
C.![]()
D.![]()
(2)25℃时,在20mL 0.1molL﹣1氢氟酸中加入V mL 0.1molL﹣1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 . 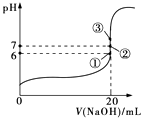
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F﹣)﹣c(Na+)=9.9×10﹣7 molL﹣1
C.②点时,溶液中的c(F﹣)=c(Na+)
D.③点时V=20mL,此时溶液中c(F﹣)<c(Na+)=0.1molL﹣1
(3)物质的量浓度均为0.1molL﹣1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是 .
(4)Na2CO3溶液显碱性是因为CO32﹣水解的缘故,请设计简单的实验事实证明之 .
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H﹣O﹣F.HFO与水反应得到HF和化合物A,每生成1mol HF转移mol电子.