题目内容
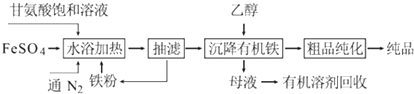
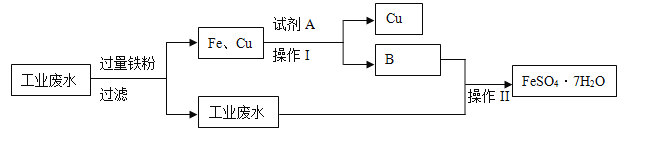
【题目】某工厂的工业废水中含有大量的FeSO4 、较多的Cu2+ 、H+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。其一种生产工艺如下:
回答下列问题:
(1)写出工业废水中加入过量铁粉发生化学反应离子方程式,并用“单线桥”表示电子转
移方向和数目_________________________。
(2)试剂A化学式___________;生成物B化学式__________。
(3)操作I的名称________,操作II的名称______________。
【答案】 ![]() H2SO4 FeSO4 过滤 蒸发结晶
H2SO4 FeSO4 过滤 蒸发结晶
【解析】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+、H+和少量的Na+,先加过量铁粉,过滤,得到的溶液为FeSO4,固体为Cu和多余的铁,再向固体中加过量稀硫酸,过滤得到Cu,溶液B为FeSO4,蒸发结晶得到硫酸亚铁晶体。
(1)工业废水中加入过量的铁粉,除了中和酸,还与铜离子反应生成铜,该过程的主要目的是除去铜离子,反应的离子方程式为Fe+ Cu2+ =Fe2+ + Cu,电子转移方向和数目用“单线桥”表示为![]() ,故答案为:
,故答案为:![]() ;
;
(2)试剂A为稀硫酸,生成物B为FeSO4,故答案为:H2SO4;FeSO4;
(3)操作I为过滤,操作II为蒸发结晶,故答案为:过滤;蒸发结晶。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
化学式 | HF | H2CO3 | HClO |
电离平衡常数(Ka) | 7.2×10﹣4 | K1=4.4×10﹣7 | 3.0×10﹣8 |
(1)将浓度为0.1molL﹣1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是 .
A.c(H+)
B.c(H+)c(OH﹣)
C.![]()
D.![]()
(2)25℃时,在20mL 0.1molL﹣1氢氟酸中加入V mL 0.1molL﹣1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 . 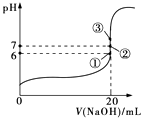
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F﹣)﹣c(Na+)=9.9×10﹣7 molL﹣1
C.②点时,溶液中的c(F﹣)=c(Na+)
D.③点时V=20mL,此时溶液中c(F﹣)<c(Na+)=0.1molL﹣1
(3)物质的量浓度均为0.1molL﹣1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是 .
(4)Na2CO3溶液显碱性是因为CO32﹣水解的缘故,请设计简单的实验事实证明之 .
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H﹣O﹣F.HFO与水反应得到HF和化合物A,每生成1mol HF转移mol电子.