题目内容
【题目】(1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________;
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________;

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
【答案】Ba2++OH-+H++SO42- = BaSO4↓+ H2O 10000d/(365+1000V) mol·L-1 18:3:2 CuSO4·H2O 2Fe2++14I-+8Cl2 =2Fe3++7I2+16Cl-
【解析】
根据物质的性质书写离子方程式;根据气体摩尔体积及物质的量间的关系计算物质的量浓度;根据图象信息结晶水的质量并计算书写化学式;根据电子转移守恒配平书写离子方程式。
(1)沉淀刚好完全时,表示硫酸氢钠用量最少,与Ba2+刚好完全反应,发生的化学方程式为:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,转化为离子方程式则为:Ba2++OH-+H++SO42-= BaSO4↓+ H2O;
(2)由题,n(HCl)=V(HCl)/Vm=224L÷22.4L/mol=10mol,m总=m(HCl)+m(H2O)=n(HCl)×M(HCl)+V(H2O)×ρ(H2O)=10×36.5+V×103×1=(365+1000V)g,![]() ,c(HCl)=
,c(HCl)=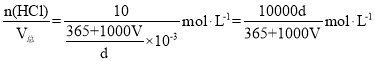 ,故答案为:
,故答案为:![]() ;
;
(3)由题可以写出氯化钠、氯化镁、氯化铝与硝酸银反应的化学方程式:NaCl+AgNO3=AgCl↓+NaNO3,MgCl2+2AgNO3=2AgCl↓+Mg(NO3)2,AlCl3+3AgNO3=3AgCl↓+Al(NO3)3,若假设硝酸银物质的量浓度为1mol/L,氯化钠、氯化镁、氯化铝与硝酸银反应消耗硝酸银体积分别为3L、2L、3L,则氯化钠、氯化镁、氯化铝与硝酸银反应消耗硝酸银物质的量为3mol、2mol、3mol,将三者消耗硝酸银物质的量代入方程式,可以得出氯化钠、氯化镁、氯化铝的物质的量分别为3mol、1mol、1mol,因为三者物质的量浓度之比为1:2:3,可列出等式为:三种溶液的体积之比3/1:1/2:1/3,化简可以得到:三种溶液的体积之比18:3:2,故答案为:18:3:2。
(4)由图可以得知,200℃时,五水合硫酸铜并未脱水完全,分子中还有一定量的水存在,5.00g五水合硫酸铜,物质的量为5g÷250g/mol=0.02mol,所以n(CuSO4)=0.02mol,n(H2O)=0.1mol,200℃时,固体质量为3.56g,所以含有水分质量为0.36g,n(H2O)=m/M=0.36g÷18g/mol=0.02mol,可以得出固体化学式为:CuSO4H2O,故答案为:CuSO4H2O。
(5)由题,根据氧化还原反应得失电子数的规律,可以写出方程式为:7FeI2+8Cl2=2FeCl3+7I2+5FeCl2,转化为离子方程式可得出:2Fe2++14I-+8Cl2 =2Fe3++7I2+16Cl-,故答案为:2Fe2++14I-+8Cl2 =2Fe3++7I2+16Cl-。

