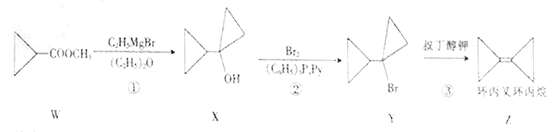
题目内容
【题目】下列反应的离子方程式书写正确的是
A. 氯气与碘化钾溶液反应:Cl2 + I- = Cl- + I2
B. 醋酸除去水垢:2H+ + CaCO3 = Ca2+ + CO2↑ + H2O
C. 铜和浓硝酸反应:Cu + 4H+ + 2NO![]() = Cu2+ + 2NO2↑ + 2H2O
= Cu2+ + 2NO2↑ + 2H2O
D. 二氧化锰与浓盐酸反应:MnO2 + 4H+ + 4Cl- ![]() Mn2+ + 2Cl2↑ + 2H2O
Mn2+ + 2Cl2↑ + 2H2O
【答案】C
【解析】
A.氯气与碘化钾溶液反应正确的离子方程式为:Cl2 +2I- = 2Cl- + I2,故A错误;
B.醋酸除去水垢,醋酸为弱酸,化学式不能拆,正确的离子方程式为:2CH3COOH + CaCO3 = Ca2+ +2CH3COO-+ CO2↑ + H2O,故B错误;
C.铜与浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式为:Cu + 4H+ + 2NO![]() = Cu2+ + 2NO2↑ + 2H2O,故C正确;
= Cu2+ + 2NO2↑ + 2H2O,故C正确;
D.浓盐酸与二氧化锰共热生成氯气,离子方程式为:MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2↑ + 2H2O,故D错误。
Mn2+ + Cl2↑ + 2H2O,故D错误。
故选C。

【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。