题目内容
【题目】可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),在温度为973 K时,平衡常数K=1.47,在1 173 K时,K=2.15。
FeO(s)+CO(g),在温度为973 K时,平衡常数K=1.47,在1 173 K时,K=2.15。
(1)写出该反应的平衡常数表达式_____。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件再达平衡后(填“增大”“减小”或“不变”):
①升高温度,CO2的平衡浓度_____,
②再通入CO2,CO2的转化率_____,
③增大容器的体积,混合气体的平均相对分子质量_____。
(3)该反应的逆反应速率随时间变化情况如图:

①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_____(填字母)。
a.升温b.增大CO2的浓度c.使用催化剂d.增压
②如果在t3时再增加CO2的量,t4时反应又处于新平衡状态,请在图上画出t3~t5时间段的v(逆)变化曲线_____。
(4)能判断该反应达到平衡的依据是_____。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
【答案】K=![]() 减小 不变 不变 a、b
减小 不变 不变 a、b 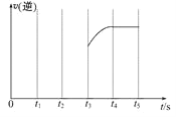 B、C
B、C
【解析】
(1)该反应的平衡常数表达式K=![]() ;
;
(2)在温度938K时,平衡常数K=1.47,在1173K时,K=2.15,说明温度升高化学平衡长水化学平衡常数,向生成物的方向移动,所以该反应正方向吸热;
①升高温度,化学平衡正向移动,CO2的平衡浓度减小;
②该反应前后气体体积不变,根据等效平衡可知,该反应前后通入CO2,平衡不移动,CO2的转化率不变;
③该反应前后气体体积不变,增大容器的体积,平衡不移动,混和气体的平均相对分子质量不变;
(3)a.升温,正、逆反应速率突然增大,随着反应的进行,生成物的浓度增大,逆反应速率增大,最后不变,a项正确;
b.增大CO2的浓度,由于容器是密闭容器,增加二氧化碳的浓度相当于增大压强,所以逆反应速率变快,最后达到平衡,逆反应速率不变,b项正确;
c.使用催化剂,正、逆反应速率突然增大,但平衡不移动,c项错误;
d.增大压强,正、逆反应速率突然增大,但平衡不移动,d项错误;
②因增加CO2的量,由于容器是密闭容器,增加二氧化碳的浓度相当于增大压强,逆反应速率增大,最后不变,所以图像为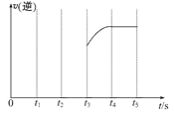 ;
;
(4)A. 因反应前后气体的系数相同,容器内压强不能作为达到平衡的标志,A项错误;
B. 反应达到平衡,c(CO)不变,能作为达到平衡的标志,B项正确;
C. 反应达到平衡,v正(CO2)=v逆(CO),C项正确;
D. 反应达到平衡,c(CO2)、c(CO)都不变,但不一定相等,D项错误;