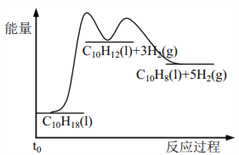
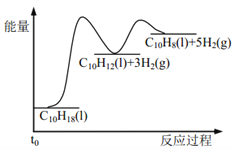
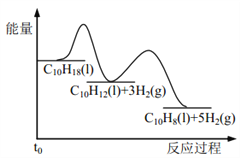
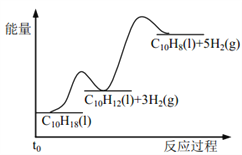
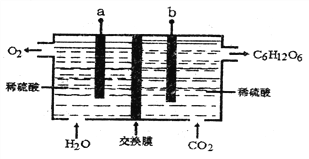
题目内容
【题目】二氧化钛被认为是现今世界上性能最好的一种白色颜料。同时它有较好的紫外线掩蔽作用,超细的二氧化钛粉末也被加入到防晒膏中制成防晒化妆品。现在某实验小组按照下面的流程来合成纳米二氧化钛。
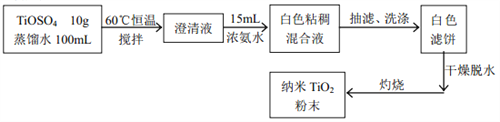
实验机理: TiOSO4+2NH3H2O = TiO(OH)2↓+(NH4)2SO4
信息提示:①钛元素化合物的性质和铝有一定的相似性。TiO2具有两性,Ti(OH)4不稳定,容易失去一分子水形成TiO(OH)2。
②钛的原子量: 48
③浓氨水的密度:0.91g cm-3
(1)灼烧时用到的硅酸盐容器是_______。
(2)下列说法正确的是_______。
A. 为了加快反应速率,可以用氢氧化钠溶液代替浓氨水
B. 为了提高产率,反应容器需要用滤液洗
C. 为了防止抽滤时滤纸破裂,抽滤时可以使用两层滤纸
D. 为了加快干燥的速率,干燥时可以用小火加热
E. 灼烧后需要冷却到室温,称量一次所得数值即为 TiO2的质量
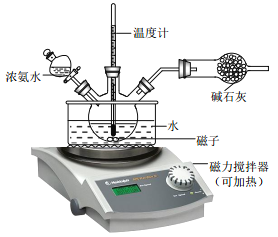
(3)为了使实验过程中尽可能的减少环境污染,同时要注意操作的安全性, 请你指出该反应装置图中的需要改进之处(指出两处即可)_____________。
(4)反应后的白色粘稠混合液经过抽滤、洗涤可以得到白色滤饼。如何证明白色滤饼已经洗干净了呢?_____。
(5)焙烧后有时会有少量的TiO2残留在容器中无法去除,我们可以用NaOH溶液将残留的TiO2洗干净。请你用化学方程式表示该洗涤原理___________。
(6)最后称得纳米 TiO2 的质量是a 克,请你计算用该方法制备 TiO2的产率________。
【答案】 坩埚 BCD ①将分液漏斗改成恒压漏斗,避免玻璃塞打开时浓氨水挥发污染环境;②因为三颈烧瓶里面有磁子,所以温度计放在外面可以避免被打碎。(温度计测水浴的温度,所以应该放在外面。)所以干燥管里放 P2O5 或无水氯化钙用于吸收氨气 取最后一次洗涤液,滴加 BaCl2 溶液,若出现白色浑浊,说明沉淀还没有洗干净;若没有白色浑浊,说明沉淀已经洗干净了 TiO2+2NaOH=Na2TiO3+H2O a/5
【解析】(1)黏土主要成分是硅酸盐,坩埚是由黏土烧制而成;正确答案:坩埚。
(2)根据题给信息钛元素化合物的性质和铝有一定的相似性,可知氢氧化钛能够溶于强碱,不溶于弱碱,所以不能用氢氧化钠溶液代替浓氨水,A错误;反应容器需要用滤液洗,减少生成的损失,提高了产率,B正确;为了防止抽滤时滤纸破裂,抽滤时可以使用两层滤纸,防止滤纸被弄破,C正确;干燥时可以用小火加热,可以使水分挥发完全,防止氢氧化钛的分解,加快干燥的速率,D正确; 灼烧后需要冷却到室温,至少称量2次,所得数值误差相差不到0.1克,即为 TiO2的质量,E错误;正确选项BCD。
(3)从减少环境污染角度分析,将分液漏斗改成恒压漏斗,避免玻璃塞打开时浓氨水挥发污染环境,同时干燥管里放 P2O5 或无水氯化钙用于吸收氨气;从操作的安全性角度分析,因为三颈烧瓶里面有磁子,所以温度计放在外面可以避免被打碎;正确答案:①将分液漏斗改成恒压漏斗,避免玻璃塞打开时浓氨水挥发污染环境;②因为三颈烧瓶里面有磁子,所以温度计放在外面可以避免被打碎。(温度计测水浴的温度,所以应该放在外面。)所以干燥管里放 P2O5 或无水氯化钙用于吸收氨气。
(4)检验白色滤饼固体中是否附着有硫酸根离子(用稀盐酸和氯化钡溶液),如果检验不出硫酸根离子,证明白色滤饼已经洗干净;正确答案:取最后一次洗涤液,滴加 BaCl2 溶液,若出现白色浑浊,说明沉淀还没有洗干净;若没有白色浑浊,说明沉淀已经洗干净了。
(5)TiO2具有两性,能够与强碱溶液反应生成可溶性的钛酸钠,化学方程式为:TiO2+2NaOH=Na2TiO3+H2O;正确答案:TiO2+2NaOH=Na2TiO3+H2O 。
(6)根据钛元素守恒规律:理论上TiOSO4→TiO2,钛元素没有损失,根据题意可知n(TiOSO4)=10/160mol, n(TiO2)= 10/160mol,m(TiO2)=(10÷160)×80=5g,据题意最后称得纳米 TiO2 的质量是a 克,TiO2的产率为a/5×100%=20a%;正确答案:20a%或a/5。

 阅读快车系列答案
阅读快车系列答案【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H="a" kJ mol-1。
O2(g) △H="a" kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。

① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
【题目】常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,记录数据如下表,下列说法中正确的是
混合后的溶液 | 加入的酸 | 酸的浓度/(mol·L-1) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
A. HA是强酸,HB是弱酸
B. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+)
C. 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
D. 升高温度,溶液②中![]() 增大
增大