题目内容
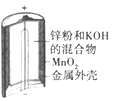
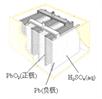
【题目】(1)铅蓄电池是典型的可充型电池,请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将_______(填变小、变大或不变);当外电路通过0.5 mol电子时,理论上负极板的质量增加__________g。
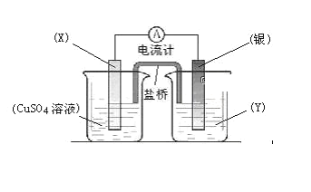
(2)用甲醇燃料电池电解AgNO3溶液,如图所示,回答下列问题:
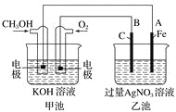
①甲池是________装置;通入CH3OH的电极名称是______,
②写出通入O2的电极的电极反应式是________________。
③A电极的电极反应式为_________________________。
④当乙池中A(Fe)极的质量增加2.70 g时,甲池中理论上消耗O2_____mL(标准状况下)
【答案】PbO2+2e-+4H++ SO42-= PbSO4+ 2H2O 小 24 原电池 负极 O2+2H2O+4e-=4OH- Ag++e-=Ag↓ 140
【解析】
(1)电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,据此分析判断;
2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,据此分析判断;
(2)①甲池是甲醇燃料电池,则甲池是原电池,乙池为电解池;燃料电池中通入燃料的一极为负极,通入氧气的一极为正极;
②通入O2的电极为正极,电解质为碱性环境;
③乙池为电解池,电极A与原电池负极相连,为阴极,则该电极上为Ag+得电子生成Ag单质;
④乙池中A(Fe)极是阴极,阴极的质量增加2.70 g,增加的是银的质量,先计算银的物质的量,再根据转移电子守恒可得关系式4Ag~O2,进而计算甲池中理论上消耗O2的物质的量。
(1)电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;放电时,电解液中H2SO4的浓度将减少;当外电路通过0.5mol电子时,依据电子守恒计算理论上负极板的质量增加0.25mol×303g/mol-0.25mol×207g/mol=24g;
2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;放电时,电解液中H2SO4的浓度将减少;当外电路通过0.5mol电子时,依据电子守恒计算理论上负极板的质量增加0.25mol×303g/mol-0.25mol×207g/mol=24g;
故答案为:PbO2+2e-+4H++ SO42-= PbSO4+ 2H2O;小;24;
(2)①甲池是甲醇燃料电池,则甲池是原电池,乙池为电解池;燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,故通入CH3OH的电极名称是负极;
故答案为:原电池;负极;
②通入O2的电极为正极,电解质为碱性环境,则电极反应式是O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
③乙池为电解池,电极A与原电池负极相连,为阴极,则该电极上为Ag+得电子生成Ag单质,电极反应式为Ag++e-=Ag↓;
故答案为:Ag++e-=Ag↓;
④乙池中A(Fe)极是阴极,阴极的质量增加2.70 g,增加的是银的质量,其物质的量为![]() ,根据转移电子守恒可得关系式4Ag~O2,所以V(O2)=nVm=
,根据转移电子守恒可得关系式4Ag~O2,所以V(O2)=nVm=![]() ;
;
故答案为:140。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因__________________(用离子方程式和相应的文字叙述)。
②在NaHA水溶液中各离子浓度的大小关系是_______________________________
(2)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的_____(填写物质的名称)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________(填化学式)。
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(![]() )从大到小顺序为__________________(填序号)。
)从大到小顺序为__________________(填序号)。
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=_________。
(5)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知:
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
加入NH3·H2O调pH=8可除去______(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是__________________________________________。