题目内容
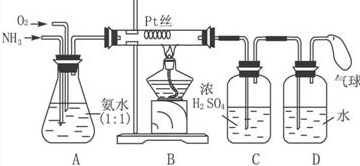
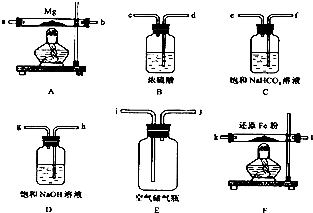
7.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).已知实验中可能会发生下列反应:①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;②3Mg+N2 $\frac{\underline{\;点燃\;}}{\;}$Mg3N2;③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑; ⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).
回答下列问题:
(1)在设计实验方案时,除装置A、D、E外,还应选择的装置有BF(填字母代号),选择装置D目的为D的目的是除去空气中的CO2,避免反应③发生;
(2)通气后,应先点燃F处的酒精灯;如果同时点燃A、F装置的酒精灯,将会使实验结果偏低(填“偏高”或“偏低”)原因如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁
(3)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成..
分析 (1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸作用是除去水蒸气,浓氢氧化钠是除去空气中二氧化碳,还原铁粉是为了除去空气中氧气;
(2)通气后,先排除空气中的杂质,所以应该先点燃F;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应,如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁;
(3)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成.
解答 解:(1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸B的作用是除去水蒸气,浓氢氧化钠D是除去空气中二氧化碳,还原铁粉F是为了除去空气中氧气,故除了装置A、D、E外,还应选择的装置有BF;D 目的是除去空气中的CO2,避免反应③发生.
故答案为:BF;D的目的是除去空气中的CO2,避免反应③发生;
(2)通气后,先排除空气中的杂质,所以应该先点燃F;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应,如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁,则会使得Mg3N2的产量偏低.
故答案为:F;偏低;如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁;
(3)依据氮化镁和水反应生成氨气,方程式为 Mg3N2+6H2O=3Mg(OH)2+2NH3↑,将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁.
故答案为:取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成.
点评 本题考查了物质实验室制备原理和装置选择,实验步骤的设计分析判断,物质性质的应用是解题关键,题目难度中等.

| 选项 | 物质(括号内为杂质) | 除去杂质的方法 |
| A | KCl(MnO2) | 加水溶解,过滤,洗涤,干燥 |
| B | FeSO4溶液(CuSO4) | 加入适量的锌粉,过滤 |
| C | NaCl溶液(CuCl2) | 加入过量的NaOH溶液,过滤 |
| D | O2(H2O) | 将混合气体通过盛有足量浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cl2+2I-→2Cl-+I2 | B. | 酸性:HClO3>HIO3 | C. | 酸性:HClO4>HIO4 | D. | 稳定性:HCl>HI |
| A. |  向含有H+,Al3+,Mg2+的溶液中,逐渐加入NaOH溶液 | |
| B. | 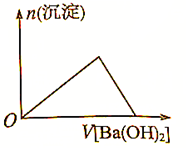 向Al2(SO4)3溶液中加入Ba(OH)2溶液 | |
| C. |  物质的量相等的镁和铝分别与等浓度、等体积的过量稀硫酸反应 | |
| D. |  向AlCl3溶液中加氨水 |
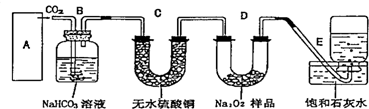
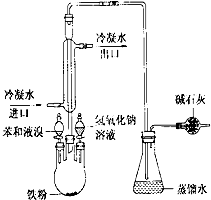 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图