题目内容
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )
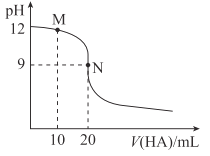
A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
【答案】C
【解析】
A.N点HA和NaOH的物质的量相等,恰好完全反应,溶质为NaA,溶液呈碱性,应选用酚酞作指示剂,A项正确;
B.M点为等物质的量浓度的NaOH和NaA的混合液,溶液呈碱性,由电荷守恒可知:c(Na+)>c(A-),B项正确;
C.N点为NaA溶液,物质的量浓度为0.005mol/L,PH=9,c(H+)=1×10-9mol/L,c(OH-)=1×10-5mol/L,NaA中的A-发生水解:A-+H2O![]() HA+OH-,c(OH-)≈c(HA),则
HA+OH-,c(OH-)≈c(HA),则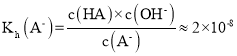 ,则
,则![]() ,C项错误;
,C项错误;
D. N点为NaA溶液,存在质子守恒:c(H+)+ c(HA)=c(OH-),故D正确。
故选C。

练习册系列答案
相关题目