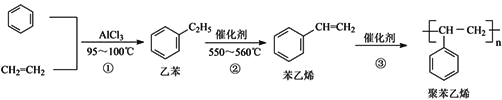
题目内容
【题目】Ⅰ.下图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
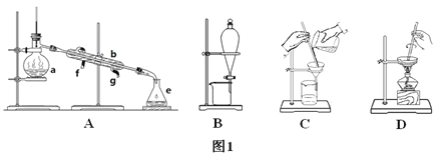
(1)从氯化钾溶液中得到氯化钾固体选择装置________(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置________。
(2)从碘水中分离出I2选择装置________,该分离方法的名称为________。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:
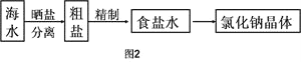
(3)粗盐中含![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
A.⑤②③①④⑥⑦ B.⑤①②③⑥④⑦ C.⑤②①③④⑥⑦ D.⑤③②①⑥④⑦
(4)写出上述实验步骤中加入过量的Na2CO3溶液时发生反应的离子方程式:______________________,_______________________。
(5)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)______________________。
【答案】D A B 萃取、分液 d ![]()
![]() CD
CD
【解析】
Ⅰ.(1)从溶液中得到固体采用蒸发结晶的方法;除去自来水中的Cl-等杂质采用蒸馏的方法;
(2)从碘水中分离出I2,碘易溶于有机溶剂而难溶于水,所以可以采用萃取方法;
Ⅱ.(3)粗盐中含Ca2+、Mg2+、SO42-等杂质,提纯过程中,先加水溶解,然后把杂质转化为沉淀或气体除去,除Ca2+用CO32-,除Mg2+用OH-,除SO42-用Ba2+.要注意除杂质的顺序,后加的试剂最好能把前面先加的过量试剂除掉;
(4)实验步骤中加入过量的Na2CO3溶液的目的是除去溶液中的Ca2+和过量的Ba2+;
(5)由海水到氯化钠晶体的实验过程中先沉淀杂质离子,然后过滤最后蒸发浓缩。
A为蒸馏装置,B为分液装置,C为过滤装置,D为蒸发结晶装置;
Ⅰ.(1)从溶液中得到固体采用蒸发结晶的方法,所以从KCl溶液中得到KCl固体采用蒸发结晶的方法,故选择装置D;氯离子易溶于水,但难挥发,水易被蒸发,所以除去自来水中的Cl-等杂质采用蒸馏的方法,故选择装置A;
(2)碘易溶于有机溶剂而难溶于水,从碘水中分离出I2可以加入四氯化碳萃取、分液,选择装置B;
Ⅱ.(3)根据分析,除去粗盐中的可溶性杂质:Ca2+、Mg2+、SO42-时,先加水溶解,所以加入过量NaOH(去除镁离子);加入过量BaCl2(去除硫酸根离子);加入过量Na2CO3(去除钙离子的多余的钡离子):碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,然后过滤,最后调节溶液的pH等于7后蒸发即可,所以其顺序是⑤③②①⑥④⑦或⑤②③①⑥④⑦;故答案为:d;
(4)实验步骤中加入过量的Na2CO3溶液的目的是除去溶液中的Ca2+和过量的Ba2+,发生反应的离子方程式有![]() 、
、![]() ;
;
(5)由海水到氯化钠晶体的实验过程中要用到蒸发的方法,为除去杂质,应过滤,主要装置是CD;故答案为:CD。