题目内容
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。某学习小组模拟工业流程设计实验制取保险粉。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。
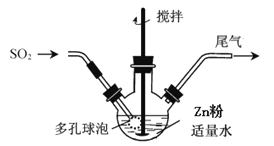
步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是______;容器中多孔球泡的作用是______。
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体”的原理是(用必要的化学用语和文字说明)______。
(3)两种方法中控制温度的加热方式是______。
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:______。
(5)甲酸钠法中生成Na2S2O4的总反应为______。
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是______。
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液______。
【答案】H2O+SO2=H2SO3,Zn+2H2SO3![]() ZnS2O4+2H2O或Zn+2SO2
ZnS2O4+2H2O或Zn+2SO2![]() ZnS2O4 增大气体与溶液的接触面积,加快气体的吸收速率 溶液中存在:Na2S2O4(s)
ZnS2O4 增大气体与溶液的接触面积,加快气体的吸收速率 溶液中存在:Na2S2O4(s)![]() Na2S2O4(aq)
Na2S2O4(aq)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)[或Na2S2O4(s)
(aq)[或Na2S2O4(s)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)],增大c(Na+),平衡向逆反应方向移动 水浴加热 Na2S2O4在水中溶解度较大,在酒精中溶解度较小 2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2 Zn(OH)2难溶于水,易与Na2S2O4分离 取少量产品配成稀溶液,加入足量稀盐酸,充分反应后静置,取上层清液,滴加BaCl2溶液,有白色沉淀生成,则可确定产品中含有Na2SO4
(aq)],增大c(Na+),平衡向逆反应方向移动 水浴加热 Na2S2O4在水中溶解度较大,在酒精中溶解度较小 2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2 Zn(OH)2难溶于水,易与Na2S2O4分离 取少量产品配成稀溶液,加入足量稀盐酸,充分反应后静置,取上层清液,滴加BaCl2溶液,有白色沉淀生成,则可确定产品中含有Na2SO4
【解析】
合成保险粉的反应物为Zn、SO2、H2O,根据温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液,据此分析解答。
(1)合成保险粉的反应物有Zn、SO2、H2O,根据温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,说明发生了:H2O+SO2=H2SO3反应,最后反应得到ZnS2O4溶液,说明又发生了:Zn+2H2SO3![]() ZnS2O4+2H2O反应,总过程也可以写成:Zn+2SO2
ZnS2O4+2H2O反应,总过程也可以写成:Zn+2SO2![]() ZnS2O4,多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率;
ZnS2O4,多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率;
(2)溶液中存在:Na2S2O4(s)![]() Na2S2O4(aq)
Na2S2O4(aq)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)[或Na2S2O4(s)
(aq)[或Na2S2O4(s)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)],增大c(Na+),平衡向逆反应方向移动,所以向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体;
(aq)],增大c(Na+),平衡向逆反应方向移动,所以向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体;
(3)根据温度控制在40~45℃可知需要控制温度的加热方式一般是水浴加热;
(4)根据步骤2中将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入食盐,才析出Na2S2O42H2O晶体,可知Na2S2O4在水中溶解度较大;根据步骤5析出的晶体用无水乙醇洗涤的目的是使晶体迅速干燥,避免溶解而减少损耗,可知其在酒精中溶解度较小;
(5)由题意可知甲酸钠、二氧化硫、碳酸钠反应生成Na2S2O4,同时生成二氧化碳,反应的方程式为2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2;
(6)锌粉法产品纯度高,可能的原因是Zn(OH)2难溶于水,易与Na2S2O4分离;
(7)设计实验证明甲酸钠法制得的产品中含有Na2SO4,要避免Na2S2O4干扰,所以取少量产品配成稀溶液,加入足量稀盐酸,充分反应后静置,取上层清液,滴加BaCl2溶液,有白色沉淀生成,则可确定产品中含有Na2SO4。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案【题目】25℃下,根据三种酸的电离常数,下列判断正确的是
酸 | HX | HY | HZ |
电离常数K | 1×10-7 | 9×10-6 | 1×10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液碱性最强
C.反应HX+Y-=HY+X-能够发生
D.25℃时,0.1 mol/L HX溶液的pH约为4