题目内容
【题目】25℃下,根据三种酸的电离常数,下列判断正确的是
酸 | HX | HY | HZ |
电离常数K | 1×10-7 | 9×10-6 | 1×10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液碱性最强
C.反应HX+Y-=HY+X-能够发生
D.25℃时,0.1 mol/L HX溶液的pH约为4
【答案】D
【解析】
A.酸的电离平衡常数越大,酸的电离程度越大,其溶液的酸性越强,根据表中数据知,酸的电离平衡常数HZ>HY>HX,则酸性强弱关系:HZ>HY>HX,A错误;
B.根据盐的水解规律:有弱才水解,谁弱水水解,谁强显谁性,越弱越水解,由于酸性HZ>HY>HX,,所以相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaX溶液水解程度增大,其水溶液的碱性最强,B错误;
C.强酸能和弱酸盐反应生成弱酸和强酸盐,由于酸性HY>HX,根据强酸制取弱酸知,反应HX+Y-=HY+X-不能够发生,C错误;
D.根据表格数据可知:在25℃时,HX的电离平衡常数K=1×10-7,假设0.1 mol/L HX溶液中HX电离产生的H+的浓度为a,根据电离平衡常数的含义可知K=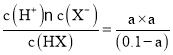 =1×10-7,a2≈1×10-8,所以a≈1×10-4,因此该溶液的pH约为4,D正确;
=1×10-7,a2≈1×10-8,所以a≈1×10-4,因此该溶液的pH约为4,D正确;
故合理选项是D。

练习册系列答案
相关题目