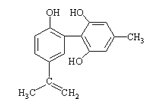
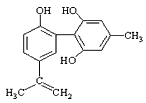
题目内容
【题目】铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是 。
(2)步骤②加入过量氯水的作用是___________,反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)下列操作会导致所测定的铁元素含量偏高的是______。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
(6)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 溶液,若溶液变成______色,说明该补血剂已变质。
【答案】(1)500mL容量瓶、胶头滴管
(2)将Fe2+全部氧化为Fe3+; 2Fe2++Cl2=2Fe3++2Cl-
(3)过滤
(4)70n/m %
(5)BC
(6)KSCN;红
【解析】
试题分析:(1)由浓溶液配制稀溶液所需的仪器有量筒、烧杯、玻璃棒、500mL容量瓶和胶体滴管,因为浓溶液已经量取,所以配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是500mL容量瓶和胶体滴管。
(2)氯水具有强氧化性,由流程图可知,加入氯水目的是将Fe2+全部氧化为Fe3+;反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量。
(4)ng氧化铁的物质的量为ng÷160g/mol=n/160mol,含有的铁元素质量为:2×n/160×56g=7n/10,则补血剂中含铁元素的质量分数为7n/10m×100%=70n/m %。
(5)A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,A错误;B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,B正确;C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,C正确;答案选BC。
(6)若补血剂变质,则补血剂中Fe2+被氧化为Fe3+,只需检验是否存在Fe3+即可,则取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加KSCN溶液,若溶液变成红色,说明该补血剂已变质。

【题目】【化学——选修3:物质结构与性质】
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做
一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。

①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。