题目内容
下列实验能达到预期目的的是 ( )
| 编号 | 实验内容 | 实验目的 |
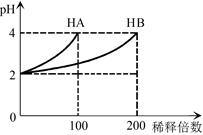
| A | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
B
解析试题分析:A.NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱。错误。B. Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+而使溶液显碱性,因此向该盐的水溶液中滴加酚酞变为红色。若向含有酚酞的Na2CO3溶液中加入少量BaC12固体,会发生反应:CO32-+Ba2+=BaCO3↓,使CO32-的水解平衡逆向移动。水解程度减小,所以溶液的减小减弱,溶液红色变浅。正确。C. 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀。但是该沉淀存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),当再滴加2滴0.1 mol/LFeCl3溶液时由于,c(Fe3+)·c(OH-)≥Ksp [Fe(OH)3],所以又生成红褐色沉淀。由于Mg(OH)2 和Fe(OH)3的构型不同,因此这只能证明沉淀在溶液中存在沉淀溶解平衡,而不能证明其Ksp的大小。错误。D.证明元素的非金属性的强弱,要看其最高价氧化物对应的水化物的酸性强弱。Na2SO3不是S的最高价含氧酸的钠盐。错误。
Mg2+(aq)+2OH-(aq),当再滴加2滴0.1 mol/LFeCl3溶液时由于,c(Fe3+)·c(OH-)≥Ksp [Fe(OH)3],所以又生成红褐色沉淀。由于Mg(OH)2 和Fe(OH)3的构型不同,因此这只能证明沉淀在溶液中存在沉淀溶解平衡,而不能证明其Ksp的大小。错误。D.证明元素的非金属性的强弱,要看其最高价氧化物对应的水化物的酸性强弱。Na2SO3不是S的最高价含氧酸的钠盐。错误。
考点:考查实验操作与实验目的的关系的知识。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案下列叙述正确的是
| A.c(H+)等于l×l0-7mol/L的溶液一定是中性溶液 |
| B.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其Kw= l×l0-14 |
| C.将水加热,Kw增大,pH不变 |
| D.任何浓度的溶液都可以用pH来表示其酸性的强弱 |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)] |
向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中
| A.c(Ca2+)、c(OH-)均增大 | B.c(Ca2+)、c(OH-)均保持不变 |
| C.c(Ca2+)、c(OH-)均减小 | D.c(OH-)增大、c(H+)减小 |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+) > c(Cl-) > c(OH-) > c(H+) |
下列各项说法中,不正确的是 ( )
| A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图 |
| B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
今有室温下四种溶液,有关叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
B.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
C.①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb= 9∶11
常温下,将20mL0.1mol/L的HCl溶液逐滴加入到20mL0.1mol/LNa2C2O4溶液中。已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是
| A.c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4) |
B.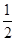 c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) |
| C.c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
| D.加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 |