题目内容
9.现有常温下pH均等于5的HCl溶液和NH4Cl溶液,下列说法正确的是( )| A. | 两溶液中n (H+)相等 | B. | 两溶液中c(Cl-)相等 | ||
| C. | 两溶液中c(OH-)相等 | D. | 两溶液中水的电离程度相等 |
分析 常温下pH均等于5的HCl溶液和NH4Cl溶液,盐酸溶液对水的电离起到抑制作用,NH4Cl溶液对水的电离起到促进作用,一定温度下溶液中离子积常数不变;
解答 解:常温下pH均等于5的HCl溶液和NH4Cl溶液,盐酸溶液对水的电离起到抑制作用,NH4Cl溶液对水的电离起到促进作用,一定温度下溶液中离子积常数不变;
A、pH均等于5,溶液中氢离子浓度相同,但溶液体积不同,两溶液中n (H+)不相等,故A错误;
B、pH均等于5的HCl溶液中氯离子浓度为10-5mol/L,NH4Cl溶液中氯离子浓度大于10-5mol/L,故B错误;
C、溶液中氢离子浓度相同,一定温度下溶液中离子积常数不变,则两溶液中c(OH-)相等,故C正确;
D、常温下pH均等于5的HCl溶液和NH4Cl溶液,盐酸溶液对水的电离起到抑制作用,NH4Cl溶液对水的电离起到促进作用,两溶液中水的电离程度不相等,故D错误;
故性C.
点评 本题考查了盐类水解分析,影响水的电离平衡的因素分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
17.下列有机化合物中,刚开始滴入NaOH溶液会出现分层现象,用水浴加热后分层现象逐渐消失的是( )
| A. | 乙酸 | B. | 乙酸乙酯 | C. | 苯 | D. | 汽油 |
14.下列措施不合理的是( )
| A. | 将煤粉碎,增大固体的表面积可以有效加快煤燃烧的速率 | |
| B. | 空气过量有利于煤充分燃烧,因此鼓入空气的量越多约好 | |
| C. | 可以用在煤中加入生石灰,减少SO2气体的排放 | |
| D. | 煤的气化可以使煤发生化学反应转化为水煤气等 |
1.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl-) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
18.下列溶液中微粒间的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)═c(SO32-)-2(H2SO3) | |
| B. | 1 L 0.1 mol•L-1的(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01 mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(SO42-)>c(Na+)═c(NH4+)>c(OH-)=c(H+) |
19.碳的一种同位素${\;}_{6}^{14}$C常用于考古研究,一个该原子中含有的中子数是( )
| A. | 2 | B. | 6 | C. | 8 | D. | 14 |
 ,A的一种同分异构体B,它能和Na2CO3溶液反应生成CO2,则B的结构简式为CH3COOH;A的另一种同分异构体C,在酸性条件下水解得到D和E,且D和E的相对分子质量相同,写出C发生此水解反应的化学方程式:
,A的一种同分异构体B,它能和Na2CO3溶液反应生成CO2,则B的结构简式为CH3COOH;A的另一种同分异构体C,在酸性条件下水解得到D和E,且D和E的相对分子质量相同,写出C发生此水解反应的化学方程式: .
.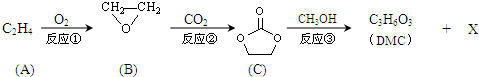
 ;XOHCH2CH2OH;
;XOHCH2CH2OH;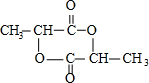 ;
;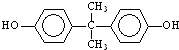 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n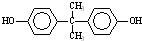 →
→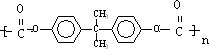 +4nCH3OH.
+4nCH3OH.