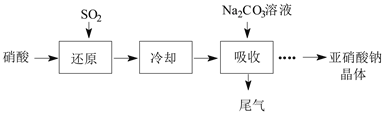
题目内容
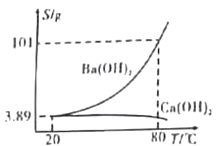
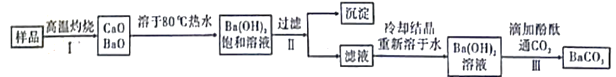
【题目】实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下[如图为Ba(OH)2和Ca(OH)2的溶解度曲线]:
下列有关说法错误的是
A.步骤Ⅰ所需主要仪器是酒精喷灯、铁坩埚、泥三角、玻璃棒等
B.步骤Ⅱ中过滤时的温度对实验无明显影响
C.步骤Ⅲ中,当观察到红色刚好消失时,即可停止通CO2
D.上述过程中涉及到分解、化合、复分解反应
【答案】B
【解析】
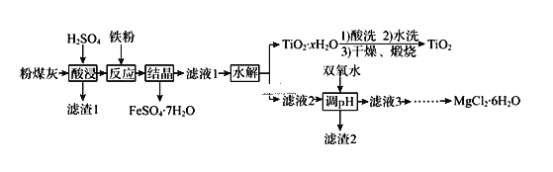
含碳酸钙杂质的碳酸钡样品经过高温灼烧,分解生成BaO、CaO,溶于80。C的热水中,生成Ba(OH)2的饱和溶液,Ca(OH)2的溶解度随温度升高而降低,此温度下Ca(OH)2的溶解度小得多,趁热过滤得到含少量Ca(OH)2的Ba(OH)2溶液,再经过冷却结晶,重新溶于水得到Ba(OH)2溶液,最后通入CO2,通过滴加酚酞确定反应进行的程度,从而得到碳酸钡,据此分析解答。
含碳酸钙杂质的碳酸钡样品经过高温灼烧,分解生成BaO、CaO,溶于80。C的热水中,生成Ba(OH)2的饱和溶液,Ca(OH)2的溶解度随温度升高而降低,此温度下Ca(OH)2的溶解度小得多,趁热过滤得到含少量Ca(OH)2的Ba(OH)2溶液,再经过冷却结晶,重新溶于水得到Ba(OH)2溶液,最后通入CO2,通过滴加酚酞确定反应进行的程度,从而得到碳酸钡。
A. 灼烧需要高温,所以选用酒精喷灯,碳酸钙、碳酸钡在高温下能与二氧化硅反应,所以不能用瓷坩埚,而用铁坩埚,铁坩埚置于泥三角上,灼烧时用玻璃棒搅拌使其受热均匀,A项正确;
B. 过滤的目的是分离Ba(OH)2和Ca(OH)2,根据溶解度曲线可知,Ca(OH)2的溶解度随温度升高而降低,则应趁热过滤,所以步骤Ⅱ中过滤时的温度对实验有影响,B项错误;
C. 当观察到红色刚好消失时,说明Ba(OH)2与CO2完全反应生成BaCO3沉淀,即可停止通CO2,C项正确;
D. 步骤I发生的是分解反应,BaO、CaO与水发生化合反应,Ba(OH)2与CO2发生的是复分解反应,D项正确;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案