题目内容
【题目】含![]() 、
、![]() 元素的物质在生产生活中有重要的用途。回答下列问题:
元素的物质在生产生活中有重要的用途。回答下列问题:
(1)基态![]() 核外电子排布式为________。
核外电子排布式为________。
(2)![]() 分子的立体构型为________。
分子的立体构型为________。
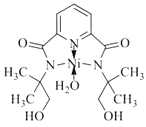
(3)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:
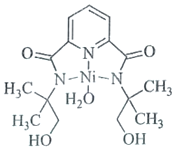
①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键______。
的配位键______。
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为________。
(5)![]() 的酸性强于
的酸性强于![]() 的原因是________,
的原因是________,![]() 的键角小于
的键角小于![]() 的原因是________。
的原因是________。
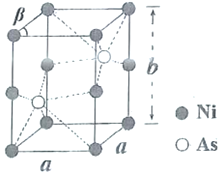
(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为________,Ni原子占据的空隙类型为________。已知晶胞参数分别为apm、apm、bpm和![]() ,则该品胞的密度为________
,则该品胞的密度为________![]() (设阿伏加德罗常数的值为NA)
(设阿伏加德罗常数的值为NA)
【答案】![]() 或
或![]() 三角锥形
三角锥形 ![]()
![]()
 As>Se>Ge
As>Se>Ge ![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强 砷原子电负性小于氮原子,所以其共用电子对离砷核距离较远,成键电子间的斥力较小,导致键角较小
酸性更强 砷原子电负性小于氮原子,所以其共用电子对离砷核距离较远,成键电子间的斥力较小,导致键角较小 ![]() 八面体空隙
八面体空隙 ![]()
【解析】
(1)根据构造原理,写出镍的核外电子排布式;
(2)根据价层电子对互斥理论,判断出价层电子对数,得出分子的构型;
(3)①根据N原子的成键方式,判断杂化类型;
②根据配位键的定义画出配位键;
(4)Ge,As,Se元素处于同一周期,根据同周期第一电离能的变化规律判断;
(5)比较分子中非羟基氧原子数目,从电负性角度分析;
(6) Ni位于顶点和棱心,As位于体心,计算出Ni和As的个数,得出分子式,六个镍原子围成八面体空隙,利用密度公式![]() ,上下底面是菱形,计算出面积S底=
,上下底面是菱形,计算出面积S底=![]() ,代入密度公式。
,代入密度公式。
(1)28号元素是镍,核外电子排布式为![]() ,基态
,基态![]() 失去最外层的两个电子,核外电子排布式为
失去最外层的两个电子,核外电子排布式为![]() 或
或![]() ;
;
(2)![]() 的中心原子为砷,最外层有5个电子,与三个氯原子形成三对共价键,剩余一对孤对电子,价层电子对数为4对,分子的立体构型为三角锥形;
的中心原子为砷,最外层有5个电子,与三个氯原子形成三对共价键,剩余一对孤对电子,价层电子对数为4对,分子的立体构型为三角锥形;
(3) ①氮原子形成一对双键,两对单键时,价层电子对数为3对,杂化方式为![]() ,形成三对单键的氮原子形成的σ键数为3对,孤对电子数为1对,价层电子对数为4对,杂化方式为
,形成三对单键的氮原子形成的σ键数为3对,孤对电子数为1对,价层电子对数为4对,杂化方式为![]() 杂化;
杂化;
②镍原子正上方的氮原子,有一对孤对电子,下方水分子提供孤对电子,镍原子提供空轨道,形成两对配位键,表示为 ;
;
(4)Ge,As,Se元素处于同一周期,同周期第一电离能呈现增大的趋势,As的最外层4p轨道为半充满状态,第一电离能高于Se和Ge,故第一电离能由大到小为:As>Se>Ge
(5) ![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强;
酸性更强;
砷原子电负性小于氮原子,所以其共用电子对离砷核距离较远,成键电子间的斥力较小,导致键角较小,![]() 的键角小于
的键角小于![]() ;
;
(6) Ni位于顶点和棱心,个数为8×![]() +4×
+4×![]() =2,As位于体心,个数为2,原子个数最简比为1:1,化学式为
=2,As位于体心,个数为2,原子个数最简比为1:1,化学式为![]() ;六个镍原子围成八面体空隙;
;六个镍原子围成八面体空隙;![]() ,M=59+75=134g/mol,N=2,上下底面是菱形,计算出面积S底=
,M=59+75=134g/mol,N=2,上下底面是菱形,计算出面积S底=![]() ,代入密度公式得到
,代入密度公式得到![]() 。
。