题目内容
【题目】亚硝酰氯(NOC1)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应:2NOC1+H2O=2HC1+NO↑+NO2↑。某化学兴趣小组设计如图装置用C12和NO制备NOC1。回答下列相关问题:
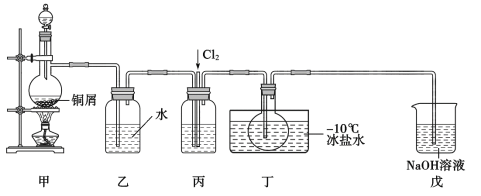
(1)甲装置发生的离子反应方程式为__,装置丙中的液体为__。
(2)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是__。
(3)装置丁中冰盐水的作用是__。
(4)经分析该套装置设计上有一处明显缺陷,改进方法是__(用文字描述)。
(5)吸收尾气时,NOCl发生反应的化学方程式为__。
(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(6)反应完成后,取烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL。则产物中NOCl纯度的计算式为__。
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 浓硫酸 排尽装置中的空气,避免氧化NO 液化亚硝酰氯,便于收集产品 在装置丁和戊之间增加一个气体干燥装置 NOCl+2NaOH=NaCl+NaNO2+H2O ![]() ×100%
×100%
【解析】
由实验装置图可知,装置甲中铜与稀硝酸反应制取一氧化氮,由于一氧化氮易被氧气氧化生成二氧化氮,装置乙中的水用于除去一氧化氮中的二氧化氮,装置丙中盛有浓硫酸,用于干燥和混合一氧化氮和氯气,装置丁用于制备亚硝酰氯,装置戊中的氢氧化钠溶液用于吸收挥发出的硝酰氯,防止污染环境,由于硝酰氯遇水发生反应,所以应在装置丁和戊之间增加一个气体干燥装置,防止水蒸气进入装置丁中硝酰氯与水发生反应。
(1)装置甲中铜与稀硝酸反应生成硝酸铜、一氧化氮和水,的离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;装置丙中盛有浓硫酸,目的是干燥和混合一氧化氮和氯气,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;浓硫酸;
(2)由于一氧化氮易被氧气氧化生成二氧化氮,实验时,先通入Cl2排尽装置中的空气后,再通入NO,防止NO被氧化,故答案为:排尽装置中的空气,避免氧化NO;
(3)由题给信息可知,亚硝酰氯的沸点为-5.5℃,遇冷易转化为液态,则装置丁中冰盐水的作用是液化亚硝酰氯,便于收集产品,故答案为:液化亚硝酰氯,便于收集产品;
(4)由于硝酰氯遇水发生反应,所以应在装置丁和戊之间增加一个气体干燥装置,防止水蒸气进入装置丁中硝酰氯与水发生反应,故答案为:在装置丁和戊之间增加一个气体干燥装置;
(5)由题给化学方程式2NOC1+H2O=2HC1+NO↑+NO2↑和NO+NO2+2NaOH=2NaNO2+H2O可知,NOCl与NaOH溶液反应生成NaCl、NaNO2和H2O,反应的化学方程式为NOCl+2NaOH=NaCl+NaNO2+H2O,故答案为:NOCl+2NaOH=NaCl+NaNO2+H2O;
(6)由题给化学方程式2NOC1+H2O=2HC1+NO↑+NO2↑可知,硝酰氯溶于水得到盐酸,由NOC1—HCl—AgNO3可得mg样品中n(NOC1)=n(AgNO3)=cmol/L×V×10—3L×10=0.01cVmol,则则产物中NOCl纯度为![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 53随堂测系列答案
53随堂测系列答案【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为___。(用字母填空,下同);
a.v(NH3)=0.05mol·L-1·min-1
b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.02mol·L-1·min-1
d.v(H2)=0.00lmol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是___。
a.反应速率v(N2)∶v(H2) ∶v(NH3)=1∶3∶2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变


