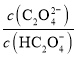题目内容
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1.2g金刚石中含有的共价键数为0.4NA
B.标准状况下,2.24 L CCl4含有个0.1 NA个CCl4分子
C.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
D.1 mol固体NaHSO4中含有阳离子的数目是2NA
【答案】C
【解析】
A.1.2g金刚石中含有C原子的物质的量=![]() =0.1mol,金刚石中每个C原子形成2个C-C键,则0.1mol金刚石中含有0.2molC-C键,碳碳单键数为0.2NA,故A错误;
=0.1mol,金刚石中每个C原子形成2个C-C键,则0.1mol金刚石中含有0.2molC-C键,碳碳单键数为0.2NA,故A错误;
B.标准状况下,CCl4是非气态,不能使用22.4L/mol来计算,故B错误;
C.过氧化钠与水的反应中,氧元素的价态由-1价变为0价,故当生成0.2mol氧气时,转移的电子数为0.4NA个,故C正确;
D.1mol固体的NaHSO4含有1mol钠离子和1mol硫酸氢根离子,所以含有的阳离子数为NA,故D错误;
故选C。

【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为___。(用字母填空,下同);
a.v(NH3)=0.05mol·L-1·min-1
b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.02mol·L-1·min-1
d.v(H2)=0.00lmol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是___。
a.反应速率v(N2)∶v(H2) ∶v(NH3)=1∶3∶2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变