题目内容
5.A、B、C三种短周期元素,原子序数依次增大,三种元素原子序数之和为35,A、C同族,B+离子核外有10个电子,回答下列问题①A、B、C三种元素分别是O、Na、S.
②A、B、C之间形成多种化合物,其中属于离子化合物的化学式分别为Na2O2、Na2O、Na2S.
③分别写出A、B、C的电子排布式:
A.1s22s22p4
B.1s22s22p63s1
C.1s22s22p63s23p4.
分析 B+离子核外有10个电子,则B为Na,A、B、C三种短周期元素,原子序数依次增大,所以C不是第ⅠA元素,A、C同主族,所以A、C的原子序数相差8,设A的原子序数为x,则C的原子序数为x+8,三种元素原子序数之和为35,则:x+11+x+8=35,解得x=8,所以A为O元素,C为S元素,据此进行解答.
解答 解:B+离子核外有10个电子,则B为Na,A、B、C三种短周期元素,原子序数依次增大,所以C不是第ⅠA元素,A、C同主族,所以A、C的原子序数相差8,设A的原子序数为x,则C的原子序数为x+8,三种元素原子序数之和为35,则:x+11+x+8=35,解得x=8,所以A为O元素,C为S元素.
①A、B、C三种元素分别是O、Na、S,故答案为:O;Na;S;
②O、Na、S之间形成多种化合物,其中属于离子化合物的化学式分别为:Na2O2、Na2O、Na2S等,
故答案为:Na2O2、Na2O、Na2S等;
③A为O元素,原子的电子排步式:1s22s22p4,B为Na,原子的电子排步式:1s22s22p63s1,C为S元素,原子的电子排步式:1s22s22p63s23p4,
故答案为:1s22s22p4;1s22s22p63s1;1s22s22p63s23p4.
点评 本题考查位置结构与性质关系的应用,推断元素是解题的关键,侧重离子化合物及电子排布式的考查,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
16.有一种烯烃经聚合反应后,形成的高分子化合物的长链结构如图所示,则这种烯烃是( )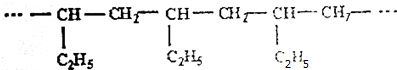
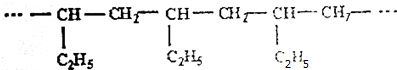
| A. | CH2=CH-CH3 | B. | CH2=CH-CH2-CH3 | C. | CH3-CH=CH-CH3 | D. | CH2=CH-CH=CH2 |
20.制备食用碘盐(KIO3)原理之一为:I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3,下列说法不正确的是( )
| A. | KClO3和KIO3均属于离子化合物,含有离子键和共价键 | |
| B. | 为防止反应的尾气造成大气污染,可以用碱性溶液吸收尾气 | |
| C. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| D. | 制备KIO3的反应中I2被氧化 |
17.检验1-溴丙烷中含有溴元素的实验步骤、操作和顺序正确的是:( )
①加入AgNO3溶液;②加入NaOH溶液;③加入适量HNO3;④加热;⑤取上层液体.
①加入AgNO3溶液;②加入NaOH溶液;③加入适量HNO3;④加热;⑤取上层液体.
| A. | ②④⑤③① | B. | ①③ | C. | ②④⑤① | D. | ①④ |
15.将30克两种金属粉末的混合物与足量稀硫酸反应,生成1克氢气.则这种混合物可能组成是( )
| A. | Mg、Al | B. | Fe、Zn | C. | Mg、Cu | D. | Al、Fe |
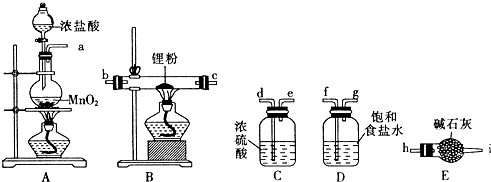
 ,B→G
,B→G
 ,E
,E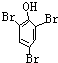 .
.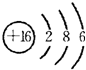 ,
, ,用电子式表示AB2的形成过程
,用电子式表示AB2的形成过程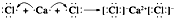 .
.