题目内容
15.将30克两种金属粉末的混合物与足量稀硫酸反应,生成1克氢气.则这种混合物可能组成是( )| A. | Mg、Al | B. | Fe、Zn | C. | Mg、Cu | D. | Al、Fe |
分析 假设金属均为+2价,根据电子转移守恒可知金属总物质的量等于氢气物质的量,计算金属平均摩尔质量,因为两种金属的混合物,故平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大.
解答 解:1g氢气物质的量为$\frac{1g}{2g/mol}$=0.5mol,假设金属均为+2价,根据电子转移守恒可知金属总物质的量等于氢气物质的量,故金属平均摩尔质量为$\frac{30g}{0.5mol}$=60g/mol,因为为两种金属的混合物,故平均摩尔质量应介于各组分之间,
A.Mg的摩尔质量为24g/mol,Al为+2价,摩尔质量为27g/mol×$\frac{2}{3}$=18g/mol,均小于60g/mol,不符合题意,故A错误;
B.Fe的摩尔质量为56g/mol,Zn的摩尔质量为65g/mol,平均摩尔质量可以为60g/mol,符合题意,故B正确;
C.Mg的摩尔质量为24g/mol,Cu不与盐酸反应,其摩尔质量可以视作无穷大,符合题意,故C正确;
D.假设Al为+2价,摩尔质量为27g/mol×$\frac{2}{3}$=18g/mol,Fe的摩尔质量为56g/mol,平均摩尔质量小于为60g/mol,不符合题意,故D错误,
故选:BC.
点评 本题考查混合物有关计算,难度中等,注意利用平均值法解答,侧重考查学生分析计算能力.

练习册系列答案
相关题目
6.下列化含物中,含有共价键的离子化合物是( )
| A. | NaCl | B. | MgBr2 | C. | NH4Cl | D. | HCl |
10.某烷烃的相对分子质量为72,与氯气发生取代反应所得的一氯代物只有一种的是( )
| A. | CH3CH3 | B. | 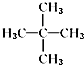 | C. |  | D. | 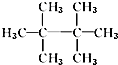 |
7.下列关于物质的检验说法不正确的是( )
| A. | 某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- | |
| B. | 将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ | |
| C. | 待检液逐滴加NaOH溶液,有白色胶状沉淀产生,后来沉淀逐渐消失,原溶液可能含有Al3+ | |
| D. | 待检液中先加氯水,无明显现象,再加入KSCN,溶液显血红色则待检液中一定含有Fe2+ |
4.物质的浓度、体积都相同的NaF和NaCl溶液中,阴阳离子总数的大小关系正确的是( )
| A. | NaF=NaCl | B. | NaF>NaCl | C. | NaF<NaCl | D. | 无法确定 |
5.下列说法正确的是( )
| A. | 判断共价化合物的依据:是否含有共价键 | |
| B. | 判断强弱电解质的依据:电解质溶解度大小 | |
| C. | 反应物和生成物所具有的总能量决定了该反应是放热还是吸热 | |
| D. | 在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 |
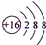 ,B
,B ,C
,C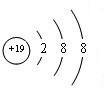 ,D
,D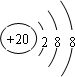 .它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).